Aux yeux de ceux qui la repoussent, l’énergie nucléaire émet une très dangereuse radioactivité. Mais que sait-on exactement de cette dernière ? N’est-elle pas omniprésente sur la planète ? En quoi l’énergie nucléaire modifie-t-elle cette situation ? En quoi consiste la radioprotection en progrès depuis les accidents de Tchernobyl et Fukushima ?
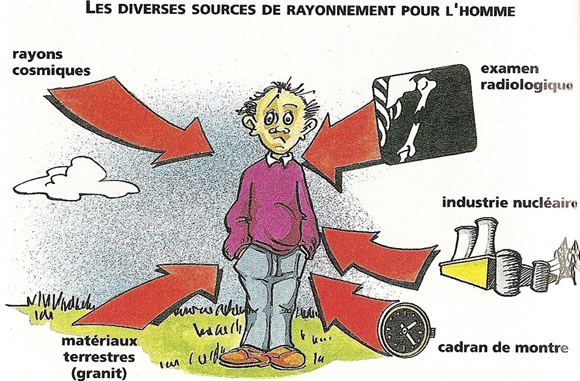
Il y a plus d’un siècle, fin 1895, Konrad Roentgen découvrait les rayons X. (Lire : L’énergie nucléaire : une brève histoire). Quelques mois plus tard, en mars 1896, Henri Becquerel décrivit pour la première fois la radioactivité. On s’aperçut alors que nous vivions tous dans une radioactivité ambiante d’origine cosmique ou terrestre et que même notre corps était radioactif par la présence principalement d’un isotope radioactif du potassium, l’isotope 40 (Figures 1 et 2).
 Très rapidement on comprit l’intérêt des rayons X en médecine et très vite on a su que les rayonnements provoquaient des effets sur l’homme, anecdotiques au début, plus graves par la suite avec le développement important de la radioscopie et il apparut dès lors le besoin de réglementer l’utilisation de ces rayonnements. Dès 1913, en Allemagne, et 1915 en Angleterre on parla de protection des malades et du corps médical, mais ce n’est qu’en 1925 à Londres puis en 1928 à Stockholm que l’on créa, lors des congrès internationaux de radiologie, deux commissions internationales, non gouvernementales ; la première, l’International Commission on Radiation Units & Measurements (ICRU, la commission internationale pour les unités de rayonnements et leur mesure), la seconde, l’International Commission on Radiological Protection (ICPR, la commission internationale de protection radiologique chargée de définir les règles de radioprotection), chargée de définir les règles de radioprotection[1].
Très rapidement on comprit l’intérêt des rayons X en médecine et très vite on a su que les rayonnements provoquaient des effets sur l’homme, anecdotiques au début, plus graves par la suite avec le développement important de la radioscopie et il apparut dès lors le besoin de réglementer l’utilisation de ces rayonnements. Dès 1913, en Allemagne, et 1915 en Angleterre on parla de protection des malades et du corps médical, mais ce n’est qu’en 1925 à Londres puis en 1928 à Stockholm que l’on créa, lors des congrès internationaux de radiologie, deux commissions internationales, non gouvernementales ; la première, l’International Commission on Radiation Units & Measurements (ICRU, la commission internationale pour les unités de rayonnements et leur mesure), la seconde, l’International Commission on Radiological Protection (ICPR, la commission internationale de protection radiologique chargée de définir les règles de radioprotection), chargée de définir les règles de radioprotection[1].
Durant la Seconde Guerre mondiale, les Américains développèrent un programme militaire nucléaire d’envergure, le projet Manhattan, en portant une attention particulière à la protection des personnels engagés dans cette aventure. Les responsables de ce programme développèrent les premiers concepts de protection qui seront, après la guerre, repris par la CIPR. De médicale à l’origine, cette commission sera restructurée et se concentrera principalement durant de nombreuses années sur l’énergie nucléaire. Il faudra attendre le développement considérable des techniques d’imagerie médicale (les scanners) et les techniques de radiologie interventionnelle (les radioscopies) pour que la CIPR revienne à ses préoccupations d’origine, l’exposition des patients et des professionnels. Dans le même temps, les effets des rayonnements qu’ils soient d’origine naturelle ou artificielle étant identiques, la CIPR s’intéressera également aux rayonnements d’origine naturelle. La réglementation en matière de protection radiologique s’appuie très largement dans tous les pays y compris la France, sur les recommandations de la CIPR.
1. Radioactivité et exposition
La radioactivité est liée à la désintégration de noyaux d’atomes, particuliers, appelés pour cette raison radioactifs. Lors de cette désintégration il y a émission de particules alpha ou bêta qui peut être accompagnée de rayonnements électromagnétiques, rayonnements gamma, lorsque les atomes produits retrouvent leur état stable. Ces désintégrations peuvent s’observer dans la nature, c’est la radioactivité naturelle, ou être produites par l’homme, c’est la radioactivité artificielle (Figure 3).
Qu’elle soit d’origine naturelle ou artificielle, la radioactivité se manifeste de la même façon, par une ionisation des atomes et molécules touchés, elle se mesure par les mêmes méthodes et produit les mêmes effets sur l’homme et la matière. On la définit aujourd’hui en becquerel (Bq) qui correspond à une désintégration par seconde et les doses reçues par l’homme sont exprimées en sievert (Sv) (voir plus loin).
Le temps nécessaire pour que la moitié des atomes initialement présents se soit désintégrés s’appelle la période radioactive. Par analogie le temps nécessaire pour que la moitié d’un radionucléide disparaisse du corps humain s’appelle la période biologique. Si pour un poids égal, un produit est plus radioactif qu’un autre, on dit que sa radioactivité spécifique est plus grande, elle est inversement proportionnelle à la période radioactive.
La radioactivité n’est pas la seule source de rayonnements ionisants, les rayons X correspondant au réarrangement des cortèges électroniques des atomes ionisent également la matière qu’ils traversent.
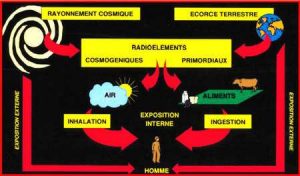
L’irradiation d’un individu est liée à une exposition externe lorsque la source de rayonnement est à l’extérieur de l’organisme, cette exposition cesse dès que la source de rayonnement est suffisamment éloignée ou que l’on interpose un écran d’épaisseur suffisante. Elle augmente avec l’activité de la source de rayonnement, sa proximité et la durée de l’irradiation. À l’inverse, si la source radioactive est à l’intérieur de l’organisme, l’irradiation est liée à une exposition interne, elle continue tant que le radionucléide n’est pas éliminé, même si l’exposition de l’homme à la source de contamination a cessé. L’exposition qui résulte de l’incorporation de radionucléides dépend donc de l’activité ingérée ou inhalée, de la nature du polluant et du temps que met notre organisme pour l’éliminer. Dans le cas de l’inhalation, l’activité incorporée (Bq) se déduit de l’activité volumique de l’air inspiré (Bq.m-3) et du débit respiratoire moyen de l’individu exposé (m3.h-1). Dans le cas de l’ingestion, il s’agit d’estimer les activités massiques (Bq.kg-1) et les quantités moyennes des aliments consommés (kg.j-1 ou kg.an-1).
1.1. Les sources naturelles d’irradiation
L’homme est immergé dans un bain de rayonnements ionisants, une partie provient du rayonnement cosmique. Au niveau de la mer, on estime que la dose efficace liée à la composante cosmique est d’environ 270 µSv par an. Les populations vivant à des altitudes élevées reçoivent des doses plus grandes, les habitants de Denver, 1.600m (Colorado) reçoivent près du double de la dose reçue au niveau de la mer (570 µSv pour la composante cosmique) ceux de Mexico, 2.240 m (Mexique), 820 µSv. Enfin, ceux de La Paz 3.900m, en Bolivie reçoivent 2 mSv par an.
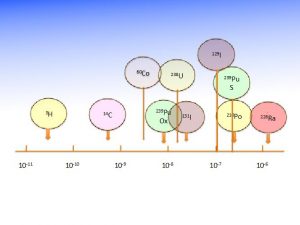
L’irradiation des populations par les radionucléides cosmogéniques provient essentiellement du tritium (isotope le plus lourd de l’hydrogène, (3H), et du carbone 14 (14C).) Les isotopes 7 du béryllium (7Be) et 22 du sodium (22Na) contribuent plus faiblement. Cette irradiation par les radionucléides cosmogéniques est très légèrement supérieure à 12 µSv par an.
Deux types d’activités humaines peuvent augmenter les irradiations naturelles par les rayonnements cosmiques; les transports aériens et les activités spatiales. À bord de la station orbitale internationale un débit de dose moyen de 30 à 40 µSv/h a été mesuré. Compte tenu de la nature des rayonnements et des variations liées aux éruptions solaires, on estime que le personnel à bord de stations orbitales reçoit en moyenne une dose efficace journalière de 1 mSv.
À l’altitude de croisière des avions long-courriers, entre 9.000 et 11.000 m le débit moyen de dose équivalente est de 2 à 3 µSv/h sur le vol Paris-Buenos Aires et est minimum au passage de l’équateur. Lors d’un vol polaire Paris-Tokyo le débit de dose équivalente est six à sept fois supérieur à proximité du pôle magnétique, montrant ainsi l’effet protecteur des ceintures de Van Allen. La dose efficace annuelle atteint en moyenne 5 mSv par an pour le personnel navigant long courrier, et peut atteindre 10 mSv pour certains équipages pratiquant fréquemment des vols polaires. L’exposition est de 3 à 5 fois plus faible pour les vols domestiques. En France, il existe un système qui permet la gestion des personnels navigant mais aussi qui informe aussi les passagers intéressés par la dose reçue durant leur vol (www.sievert-system.org). Ce système est développé conjointement par l’Institut de radioprotection et de sûreté nucléaire (IRSN), la direction générale de l’aviation civile (DGAC) l’Observatoire de Paris, l’Institut polaire français – Paul Emile Victor (IPEV).
Trois radionucléides primordiaux sont particulièrement importants pour l’exposition d’origine tellurique car ils produisent des radionucléides secondaires par décroissance radioactive, ce sont des isotopes de l’uranium et du thorium (238U, 232Th et 235U). Ces radionucléides secondaires sont classés par famille nommée par l’isotope initial, famille de l’uranium 238 par exemple. Ces trois radionucléides primordiaux subsistent sur terre car leur période radioactive est proche de l’âge de la terre, il en reste encore sur notre planète. La concentration des radionucléides primordiaux dans les sols est plus grande dans les roches ignées que dans les roches sédimentaires. La teneur moyenne en radium-226 (226Ra) résultant de la désintégration de l’uranium 238 varie de 0,4 à 4,1 Bq/kg dans les basaltes de 1 à 370 Bq/kg dans les granites, mais les variations peuvent être encore plus grandes, de 1 à 1.800 Bq/kg dans les gneiss. Il en résulte une irradiation externe très variable d’une région à l’autre. Il existe dans le monde des régions où l’irradiation est très largement supérieure à la moyenne mondiale : le Kerala en Inde où l’on trouve de la monazite, certaines régions du Brésil, et à un degré moindre certaines régions d’Italie, de France, de Suède, d’Iran, de Madagascar et du Nigeria (Figure 4).
Les eaux minérales reflètent bien les variations des teneurs de ces radionucléides dans les sols. D’après les valeurs publiées, la dose engagée qui résulte de la consommation quotidienne d’eau minérale varie en moyenne de 30 µSv pour des eaux plates à 280 µSv pour des eaux gazeuses provenant d’un bassin radifère.
Parmi les descendants de ces radionucléides primordiaux (235U, 232Th et 238U,) le radon est la principale source d’irradiation des populations, avec ses trois isotopes naturels, 219Rn, 220Rn et 222Rn. Ce sont des émetteurs a auxquels ils leur sont associés des émissions g liées à leurs descendants. Les concentrations moyennes dans les habitations sont très variables selon les lieux et les pays (10 à 10.000 Bq/m3. L’irradiation annuelle pour les populations est en moyenne de 1.200 µSv pour 222Rn et de 73 µSv pour 220Rn, c’est donc la source principale d’irradiation de l’homme. L’IRSN a dressé une carte du potentiel radon en France, il est lié à la composition granitique du sol. En termes d’irradiation interne, le 222Rn et ses descendants représentent 70% de la dose, le 40K, 13%, le 220Rn et ses descendants 13%, le 210Pb et 210Po 13%. Les autres radionucléides délivrent des doses peu significatives.
L’homme standard (70 kg) contient en moyenne 4.400 Bq de 40K, 3.700 Bq de 14C, 455 Bq de rubidium -87 (87Rb), 40 Bq de 3H, 4Bq de 226Ra
En résumé, la dose efficace moyenne au niveau mondial est estimée selon le United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR) à 2,4 mSv pour les sources d’origine naturelle. Cette valeur moyenne se décompose en 1,3 mSv liés au radon, 0,39 mSv au rayonnement cosmique, 0,46 mSv au rayonnement tellurique, et 0,23 mSv liée à l’irradiation interne à l’exception du radon. Ces valeurs peuvent varier très significativement selon le lieu d’habitation. Malgré cette variation importante aucune étude épidémiologique solide n’a à ce jour montré d’effets sur la santé si ce n’est quelques études concernant le radon, fortement entachées par le rôle écrasant du tabac qu’il est toujours difficile d’éliminer.
1.2. Les sources d’origine naturelle modifiées par la technologie
De nombreux produits sont naturellement radioactifs et ne conduisent à une irradiation des populations que si ils sont transformés avant exploitation. Ainsi, les engrais irradient les populations qui les utilisent. L’irradiation cosmique étant inéluctable, les transports aériens et les activités spatiales exposent les populations à un surcroît d’irradiation, ceci a conduit la CIPR à intégrer les personnels navigants dans la catégorie des travailleurs soumis à une exposition professionnelle.
Pour les énergies fossiles, le charbon est le contributeur principal. Il contient plus de produits radioactifs que toute autre source d’énergie fossile. Les installations modernes de production d’énergie limitent leurs rejets par filtration des cendres et diminuent ainsi leur contribution à la dose efficace annuelle à des niveaux inférieurs à 10 mSv. Les minerais phosphatés sont la source principale de productions d’engrais. Leur utilisation est la première source de contamination de la planète par le radium-226. Les phosphogypses, utilisés dans les plâtres et les ciments, délivrent par inhalation du radon qui relargue une dose annuelle de 0,6 mSv par an. La convention pour la protection du milieu marin dans l’Atlantique Nord-Est (OSPAR) montre que l’extraction pétrolière dans cette zone irradie les populations 14 fois plus que les rejets de l’industrie nucléaire.
1.2.1. L’exposition médicale
Les doses reçues proviennent d’examens radiologiques à visée diagnostique (exposition externe), de traitements de médecine nucléaire (exposition interne) ou de traitements de radiothérapie. Une radiographie pulmonaire délivre une dose de l’ordre de 0,1 mSv, un examen par scanner du thorax ou de l’abdomen une dose de 10 mSv. La part due aux examens scanographiques ne cesse de grandir et représente, en France, un quart de l’exposition médicale dont 26% est liée aux radiographies conventionnelles, 58% aux examens par scanners et 10% aux examens de médecine nucléaire.
1.2.2. L’exposition professionnelle
Selon l’IRSN, 35.4665 personnes ont été surveillées en 2012 dans le cadre des activités soumises à réglementation. Ce sont les activités médicales et vétérinaires qui représentent la plus grosse contribution (62%), devant l’industrie nucléaire (20%), devant les industries non nucléaires (près de 10%) la recherche et l’enseignement (4%). En terme de dose individuelle moyenne sur l’effectif exposé ce sont les industries non nucléaires qui délivrent les doses les plus élevées (1,54 mSv) devant l’industrie nucléaire (1,16 mSv) et les activités médicales (0,49 mSv). À l’inverse, en termes de dépassement des limites réglementaires (20 mSv/an pour les travailleurs exposés) c’est parmi les activités médicales que l’on note le plus de dépassements de la limite: 12 en 2012, contre 1 dans l’industrie nucléaire et 1 dans les industries non nucléaires.
2. L’origine des règles de radioprotection, la CIPR
Trois organismes internationaux sont à la base de toutes les réglementations sur le plan international. Par ordre de création ;
La Commission internationale des unités et mesures radiologiques, ICRU pour International Commission on Radiation Units and Measurements, a été créé en 1925, à l’occasion du 1er Congrès international de radiologie. Initialement appelée International X-Ray Unit Committee. Depuis près de 90 ans, l’ICRU a établi des standards internationaux pour les unités et la mesure de la radioactivité et des rayonnements ionisants.
La Commission internationale de protection radiologique (CIPR), ICRP pour International Commission on Radiological Protection une organisation non gouvernementale constituée d’experts internationaux indépendants cooptés sur la base de leurs compétences scientifiques. Créée en 1928, à l’initiative des médecins radiologues elle s’est profondément réformée après la seconde guerre mondiale. Elle a pour objectif d’émettre des recommandations en matière de radioprotection. A ce jour, ses recommandations sont reprises, à quelques nuances près par la quasi totalité des pays. La France, base sa réglementation sur les recommandations de la CIPR via une directive de l’Union Européenne.
L’UNSCEAR (United Nations Scientific Committee on the Effects of Atomic Radiation) a été créé par l’Assemblée générale des Nations Unies en 1955. Son mandat dans le système des Nations Unies est « l’évaluation des niveaux de rayonnement auxquels la population mondiale est exposée ou pourrait être exposée à l’avenir » et l’étudie des effets de l’exposition aux rayonnements ionisants. Les gouvernements et les organisations à travers le monde, dont la CIPR, s’appuient sur les estimations de ce comité pour évaluer le risque des rayonnements ionisants et établir des mesures de protection.
La CIPR est constituée d’experts de tous pays, choisis par cooptation, entièrement indépendants des gouvernements. Elle est constituée d’un Comité principal que l’on appelle généralement La Commission et de Comités techniques, au nombre de cinq, sur laquelle elle s’appuie pour définir ses recommandations. Ces recommandations, émises régulièrement, sont destinées à l’ensemble des travailleurs soumis aux rayonnements ionisants, que ceux-ci soient d’origine naturelle ou humaine. Elles sont également destinées à la protection du public et des patients pour les applications médicales.
Les recommandations de la CIPR sont généralement reprises par l’ensemble des États. Ainsi pour l’Union européenne, la commission les reprend sous forme d’une directive qui s’impose aux États membres : la dernière, la directive 2013/59, a été publiée le 5 décembre 2013 et devra être transposée en droit français d’ici à 2017. Pour les autres pays, aucune structure similaire n’existant, plusieurs agences internationales telles que l’Agence internationale de l’énergie atomique (AIEA), l’Organisation de coopération et de développement économique (OCDE), l’Organisation mondiale de la santé (OMS), la Food and agriculture organization (FAO), le Bureau international du travail (BIT) , la Population association of America (PAA), se sont regroupées pour les transformer en Basic safety standards (BSS) utilisables tels quels par les pays qui le souhaitent. Aux États-Unis, c’est une commission nationale, la National Council on Radiation Protection and Measurement (NCRP) qui établit ses propres recommandations qui sont à la base de leur réglementation. Cette commission nationale s’inspire très largement des recommandations de la CIPR (Figure 5).
3. Notions de dose
La grandeur utilisée pour quantifier la quantité de rayonnement reçu est la dose. C’est donc l’estimation de la dose, la dosimétrie, qui permet de quantifier l’atteinte de l’homme résultant des différents types d’expositions. Elle ne se mesure pas chez l’homme, on l’estime à partir de dosimètres. En ce qui concerne la dose reçue par un individu après contamination interne, le mode de calcul est plus difficile à mettre en œuvre, comme on peut le comprendre ci-après.
3.1. La dose absorbée
Les rayonnements émis par les substances radioactives interagissent avec la matière en y cédant de l’énergie. La quantité d’énergie cédée est appelée la dose absorbée. Elle s’exprime en Gray (Gy) qui correspond à une énergie de 1 Joule cédée dans un kilogramme de matière (1Gy = 1 J/kg). Cette cession d’énergie est à l’origine de perturbations dans la matière exposée, l’ionisation des atomes qui la constitue. L’effet biologique observé n’est cependant pas lié à la quantité de chaleur, minime, mais au site touché, brin d’ADN par exemple. C’est pourquoi, pour la matière vivante, la dose absorbée n’est pas seule représentative du risque encouru. Deux concepts ont donc dû être créés : la dose équivalente et la dose efficace.
3.2. La dose équivalente
Tous les rayonnements ne produisent pas les mêmes effets. Si l’énergie est cédée dans un petit volume de tissus, la nuisance sera plus grande que si cette même énergie est cédée sur une plus grande distance. Le rayonnement alpha, dont le parcours moyen dans la matière vivante est de 40 µm est à priori plus nocif que le rayonnement gamma qui n’est que partiellement arrêté par l’homme. Le concept de dose équivalente permet d’exprimer de manière équivalente ces deux effets, en tenant compte d’un facteur de nocivité du rayonnement.
La dose équivalente à l’organe HT,R dans un tissus T liée à l’irradiation par le rayonnement R est donnée par l’équation :
HT,R = S WR DT,R
R
où DT,R est la dose absorbée à l’organe T par l’irradiation R et WR le facteur de pondération lié à la nature du rayonnement R. La dose équivalente totale, HT, est la somme de HT,R pour tous les types de rayonnement. Le facteur de qualité étant sans dimension, l’unité est la même que pour la dose absorbée J.kg-1 : son nom spécifique est le sievert (Sv).
La publication 103 de la CIPR (ICRP 2007) attribue à chaque type de rayonnement les facteurs de pondération WR suivants:
Photons de toutes énergies 1
Électrons et muons de toutes énergies 1
Protons et pions chargés 2
Alpha, Fragments de fission, Noyaux lourds 20
Neutrons: trois fonctions empiriques dépendant de l’énergie, qui conduisent, par exemple à des valeurs de 2,5 pour des neutrons de moins de 10 keV, 5 pour des neutrons de 50 keV, 10 pour des neutrons d’environ 100 keV, 20 pour des neutrons d’environ 1 MeV, 10 pour des neutrons de 10 MeV, 5 pour des neutrons de 100 MeV pour atteindre des valeurs proches des protons pour des énergies très élevées supérieures à 1 GeV.
Dans le cas du rayonnement alpha, la dose équivalente est égale à vingt fois la dose absorbée, alors que pour le rayonnement gamma (photons), elle est égale à la dose absorbée.
Ce concept de dose équivalente est un concept simplifié qui permet d’additionner des effets biologiques produits par des rayonnements différents. Son utilité n’est que réglementaire, le scientifique ou l’épidémiologiste qui souhaite étudier les effets des rayonnements se contentera de la dose absorbée en Gy. Ces coefficients sont des estimations faites par des experts comparant l’efficacité biologique relative des différents rayonnements pour produire des cancers dans un organe. Ces coefficients de pondération n’ont donc a priori de signification qu’aux faibles doses de rayonnement, conduisant à des effets stochastiques. La dose équivalente ne devrait donc être utilisée que pour des expositions conduisant à des faibles doses.
3.3. La dose efficace
Le risque de production de cancer est lié à la dose, mais tous les tissus n’ont pas la même sensibilité aux rayonnements. C’est la dose efficace qui permet d’estimer le risque d’induction de cancer dans l’organisme entier en prenant en compte la radiosensibilité des différents tissus concernés.
La dose efficace est la somme des doses équivalentes pour chaque organe ou tissus de l’organisme pondérées par un facteur dépendant de la sensibilité aux effets stochastiques du tissu irradié WT Ces facteurs de pondération étant normalisés leur somme est égale à 1.
La dose efficace s’exprime donc par l’expression
E = S WT HT
T
La publication 103 de la CIPR (ICRP 2007) attribue les facteurs de pondération tissulaire suivants pour les organes spécifiés:
| Moelle osseuse, colon, poumon, estomac, sein, autres tissus restants | 0,12 |
| Gonades | 0,08 |
| Vessie, œsophage, thyroïde, foie | 0,04 |
| Surface osseuse, cerveau, glandes salivaires, peau | 0,01 |
Pour des raisons de calcul, les autres tissus ou organes comprennent la glande surrénale, la région extra-thoracique (ET), la vésicule biliaire, le cœur, les reins, les ganglions lymphatiques, le muscle, la muqueuse buccale, le pancréas, la prostate, l’intestin grêle, la rate, le thymus et l’utérus.
Le facteur de pondération tissulaire étant sans dimension, l’unité est la même que pour la dose absorbée et la dose équivalente à l’organe J.kg-1 : son nom spécial est comme pour la dose équivalente à l’organe, le sievert (Sv). Ainsi, à partir d’une donnée mesurable, la dose absorbée, il est possible d’estimer un risque pour l’homme à travers le concept de dose efficace.
Ces facteurs ont été modifiés par rapport aux recommandations précédentes. Ceci était dû à une plus longue observation de survivants d’Hiroshima et de Nagasaki. Le fait le plus marquant des dernières recommandations est la diminution du facteur de pondération pour les gonades. Représentant le risque d’effets héréditaires, il a été ramené de 0,20 à 0,08 pour tenir compte de l’absence de tels effets près de 60 ans après l’exposition de cette population. Il faudra attendre encore une ou deux générations pour confirmer éventuellement la tendance actuelle montrant l’absence d’effet héréditaire lié à l’irradiation. Ce facteur représentait la précaution des recommandations de la CIPR qui, à son origine, voulait prendre en compte dans son système de protection un risque héréditaire potentiel.
Ces facteurs de pondération sont établis pour des risques stochastiques et le sievert n’a de sens que pour les effets tardifs (cancer par exemple) et les faibles doses. À l’inverse le Gy qui n’incorpore pas ce facteur de pondération est valable quelle que soit la dose, il relate un simple transfert d’énergie. La CIPR rappelle que le Gy doit être utilisé pour toutes les études épidémiologiques concernant un organe (thyroïde par exemple). Malgré ces rappels, on note encore bien souvent sur des échelles de risques des valeurs exprimées en Sv pour des effets déterministes comme la mort par syndrome d’irradiation aiguë.
3.4. Le cas particulier de l’exposition interne, la notion d’engagement de dose
L’estimation d’une dose due à une exposition externe est a priori plus aisée que celle résultant d’une incorporation de radionucléides. En effet, l’exposition externe cesse dès que les rayonnements ne parviennent plus à l’organisme. Dans le cas d’une exposition interne, l’irradiation de l’organisme se poursuit tant que celui-ci n’a pas éliminé le radionucléide. Pour prendre en compte l’ensemble de la dose qui sera délivrée pendant tout le temps que les radionucléides séjournent dans l’organisme après leur incorporation, la CIPR a créé le concept de dose engagée. Il s’agit de la dose équivalente à l’organe ou la dose efficace à l’organisme entier qui est engagée dès lors que les radionucléides sont ingérés ou inhalés. Si l’individu exposé est un adulte, l’estimation de la dose engagée prend en compte l’irradiation de son organisme durant les 50 ans qui suivent l’incorporation, quel que soit son âge. Pour l’enfant, du nouveau-né à l’adulte (20 ans), l’estimation de la dose efficace engagée se fait par convention jusqu’à l’âge de 70 ans. Les coefficients de dose publiés par la CIPR le sont pour 50 ans ou jusqu’à l’âge de 70 ans.
La méthode de calcul de la dose équivalente engagée tient compte pour chaque tissu-cible T, de l’irradiation produite par le rayonnement émis en son sein et tout autre organe source S lorsque le rayonnement est suffisamment pénétrant et ceci au cours des années qui suivent son incorporation, 50 ans pour les adultes et jusqu’à l’âge de 70 ans pour un enfant.
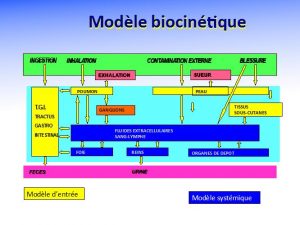
À partir des voies d’entrées, deux types de modèles dosimétriques sont proposés par la CIPR, les modèles d’entrée (pulmonaire, gastro-intestinal, la peau ou la blessure) et les modèles systémiques (Figure 6).
Les modèles d’entrées dépendent essentiellement de la physico-chimie du polluant. Un composé soluble inhalé migrera plus rapidement vers le sang qu’un composé insoluble. À l’inverse le composé insoluble s’éliminera lentement du poumon par remontée mucociliaire jusqu’au carrefour pharyngé pour suivre ensuite le transit gastro-intestinal et être finalement éliminé par voie fécale. On voit donc que le suivi des composés solubles peut se faire par la mesure des radionucléides dans les urines alors qu’on privilégiera la voie fécale pour les composés insolubles.
Le radionucléide dissous sur le site d’entrée se lie avec des molécules complexantes au niveau sanguin. La distribution du radionucléide au niveau des organes irrigués par le sang ne dépendra plus de la forme initiale mais de la stabilité du complexe véhiculé. Cette distribution est décrite par des modèles systémiques;
Pour calculer la dose engagée, il faudra pour commencer calculer la concentration du radio nucléide au niveau de l’organe sur une durée maximale de 50 ans, ou plus pour les enfants. Il faudra ensuite calculer, en fonction du temps, la dose absorbée (en Gy) délivrée dans cet organe par le radio nucléide. Ceci sera fait pour tous les organes et la dose efficace engagée sera ensuite calculée selon les modes décrits ci-dessus prenant en compte les facteurs de pondération des rayonnements et des tissus. Lorsque le rayonnement est pénétrant, l’irradiation ne s’arrête pas à l’organe. Tous les autres organes s’auto irradient. On calculera en fonction du temps l’auto irradiation de l’organe mais aussi l’irradiation par les organes adjacents. La dose engagée fera ensuite la somme de toutes les irradiations qu’elle qu’en soit l’origine. Qu’on se rassure, tous ces calculs sont effectués par la CIPR, il ne restera à l’utilisateur qu’à appliquer des coefficients de dose par unité incorporée, la DPUI.
4. Les effets des rayonnements ionisants
Il n’existe aucune exposition de l’homme aux dangers environnementaux qui ait justifié un effort de recherche aussi prolongé et aussi exhaustif que celle résultant de l’exposition aux rayonnements ionisants. Les diverses origines de cette exposition et leurs conséquences sont revues en permanence par la communauté scientifique internationale. L’UNSCEAR se charge régulièrement de faire la synthèse des données depuis 1956 et les publie dans des rapports qu’elle présente à l’Assemblée générale des Nations Unies. Ces rapports sont accessibles à tous.
La radioactivité ou les rayonnements de forte énergie provoquent en premier lieu des ionisations, d’où leur nom de rayonnements ionisants. Que les rayonnements soient d’origine naturelle ou artificielle, l’énergie nécessaire pour ioniser un atome sera la même, les effets sur la matière qu’elle soit inerte ou vivante sont identiques. On ne pourra donc pas distinguer, à dose et débit de dose égal, les effets des irradiations qu’elles soient d’origine naturelle ou humaine.
Les radiations ionisantes produisent dans la matière vivante des altérations qui peuvent avoir des conséquences à court ou à long terme. Les effets les plus graves se produisent au niveau de la molécule d’ADN, qui peut être cassée soit sur un seul de ses deux brins, soit sur les deux brins. Ces dommages peuvent êtres réparés par les mécanismes enzymatiques en place dans la cellule. Toutefois si les dommages induits par les radiations ionisantes ne sont pas correctement réparés, la cellule deviendra incapable de fonctionner ou de se diviser normalement. Ceci aboutira soit à la mort cellulaire soit à la production de cellules-filles viables mais modifiées qui transmettront à leurs descendantes des informations erronées pouvant conduire à des pathologies cancéreuses.
Dans le premier cas, et pour des doses relativement élevées, les effets au niveau des organes et tissus sont appelés déterministes car ils dépendent de la dose reçue et affectent toute la population concernée. Dans le second cas, pour des doses plus faibles, les effets sont dits stochastiques car ils apparaissent, plus ou moins tardivement, au hasard parmi la population concernée, ce sont principalement des cancers. Ils sont toujours graves et c’est leur fréquence d’apparition qui dépendra de la dose reçue. Les effets tardifs des radiations n’ont pas de caractère spécifique qui permet de distinguer ceux qui sont dus aux rayonnements ionisants de ceux qui ne le sont pas. Il n’y a aucune différence entre un cancer radio-induit et un cancer apparaissant sans cause apparente. On pourra toutefois faire un lien de présomption si un excès d’un type de cancer frappe une population irradiée comme par exemple pour la leucémie ou les cancers de la thyroïde.
4.1. Effets déterministes
Les effets déterministes précoces surviennent, par définition, peu de temps après l’irradiation, de quelques heures à quelques mois. Ce sont toujours des effets à seuil qui n’apparaissent que si la dose de rayonnement reçue par l’individu ou l’organe dépasse un certain niveau. En effet, l’irradiation peut tuer quelques cellules sans que cela n’affecte les caractéristiques physiologiques d’un organe, mais si trop de cellules disparaissent celui-ci ne pourra plus assurer correctement sa fonction, l’effet déterministe apparaîtra. Cette dose-seuil peut varier d’un tissu à un autre. Les variations individuelles existent, mais elles sont relativement faibles. Au-delà du seuil, la gravité de l’effet croît avec la dose. Les tissus les plus fragiles sont la peau, le poumon, les cellules formatrices du sang (la moelle osseuse) l’intestin et les organes sexuels. Pour certains effets, la gravité, et le pronostic vital, seront très différents si l’irradiation est localisée ou homogène. Pour le législateur, ces effets sont relativement faciles à gérer car les normes de protection sont fixées à des niveaux bien inférieurs à leurs seuils d’apparition. Ces effets ne peuvent donc survenir qu’à la suite d’incidents ou d’accidents. Récemment, le cristallin s’est ajouté à ces organes sensibles pour des doses relativement faibles.
4.1.1. Irradiation externe globale
Au-dessous de 1 Gy, les signes fonctionnels sont nuls. Le seul signe constaté pour la dose la plus faible (0,2 ou 0,3 Gy) est une chute du nombre de globules blancs (lymphopénie) temporaire régressant spontanément. Une surveillance hématologique est nécessaire, mais de telles irradiations sont sans gravité et ne nécessitent pas d’hospitalisation. Les manifestations fonctionnelles apparaissent entre 1 et 2 Gy, mais les signes physiques sont absents. Il y a altération des globules blancs, et des plaquettes. La guérison est spontanée après quelques précautions simples. L’hospitalisation nécessaire consiste en une surveillance hématologique avec ou sans transfusions et traitement antibiotiques si nécessaire pour pallier la baisse de vigilance liée à la chute des globules blancs. Au-delà de 2 Gy, des précautions très strictes s’imposent, l’hospitalisation en service spécialisé s’impose. La dose létale 50 à 60 jours se situe pour des individus non traités entre 3,5 et 4 Gy. La chute maximale du nombre des cellules sanguines se situe entre la 3° et 4° semaine, c’est à ce moment que se pose le problème vital. Paradoxalement avant cette période très critique la symptomatologie est pratiquement silencieuse. Le malade qui survit n’entre en convalescence qu’au troisième mois. Le traitement devra être entrepris dans un service spécialisé avec locaux stériles et prévention des infections. Si la dose est plus élevée que la dose létale, 8 à 12 Gy, la gravité peut être dû aux complications digestives. Le risque maximum commence 6 à 8 jours après l’irradiation. L’évolution sera très grave malgré le traitement. Des lésions pulmonaires graves apparaissent à 10 Gy, un syndrome neurologique toujours fatal intervenant pour des doses de 15 à 20 Gy.
4.1.2. Irradiations partielles
Fort heureusement une irradiation partielle ne présente pas les mêmes dangers car elle est la base de la radiothérapie qui peut délivrer des doses considérables de plusieurs dizaines de Gy au seul organe malade, doses qui tueraient le patient si elles étaient délivrées sur l’organisme entier. Les progrès considérables de cette pratique médicale sont à la base des nombreux succès en matière de guérison des cancers. Les outils se sont considérablement améliorés et permettent de délivrer la dose de radiation essentiellement dans la tumeur, respectant ainsi les tissus sains adjacents.
En cas d’irradiation partielle, la peau est le tissu le plus souvent lésé. Les manifestations sont variables, elles dépendent de la dose. Les signes physiques sont schématiquement ceux des brûlures : érythème, phlyctène, œdème, nécrose et sclérose. Aucune lésion grave n’apparaît en dessous de 10 Gy.
Dans le cas des organes reproducteurs, la production de spermatozoïdes est atteinte au niveau des testicules. On note une oligospermie transitoire et réversible spontanément à 0,5 Gy, une stérilité temporaire à 2 Gy. Pour des irradiations égales ou inférieures à 6 Gy, la stérilité est temporaire chez l’homme. L’ovaire est moins sensible que le testicule, Il faut des doses de 12 à 15 Gy pour provoquer des ménopauses artificielles chez des jeunes, 7 Gy seulement chez des femmes de 40 ans.
Le cristallin est un organe sensible, la limite de dose pour éviter l’apparition de cataractes radio-induites a été considérablement abaissée par la CIPR en 2011 et est aujourd’hui fixée à 20 mSv par an par la directive européenne. Les médecins radiologues interventionnels, cardiologues et neuroradiologues sont les plus concernés. Dans le domaine nucléaire, ce sont les opérations en boite à gants qui sont les plus touchées. Dans tous ces cas, le port de lunettes plombées est recommandé.
4.2. Effets stochastiques
Les principaux effets stochastiques sont les cancers. Ils surviennent quelques années ou quelques dizaines d’années après l’irradiation. L’effet cancérigène des rayonnements ionisants est avéré, mais il est très difficile de savoir s’il existe une dose seuil au-dessous de laquelle il ne se manifeste plus, compte tenu de l’incidence spontanée des cancers dans la population, soit 25 à 30 % dans les populations occidentales, principalement au-delà de 60 ans.
Les données les plus fiables proviennent de l’expérimentation animale. Chez l’homme, la cohorte la plus cohérente et la plus étudiée est celle des survivants des bombardements d’ Hiroshima et de Nagasaki durant la Seconde Guerre mondiale. À côté de cette cohorte (86.500 personnes) figurent d’autres cohortes, plus limitées, et correspondant très souvent à des irradiations partielles. Tel est le cas de ces femmes, qui, avant la dernière guerre, utilisaient des peintures à base de radium pour peindre les cadrans de montres lumineux, certaines sont mortes suite à des cancers osseux radio induits. Tel est aussi le cas des mineurs du radium atteints de cancers du poumon après inhalation de radon. Toutefois les informations recueillies parmi ces cohortes, si elles sont très précieuses, ne donnent que des informations limitées à un ou deux types maximum de cancers.
Ne connaissant pas de manière irréfutable les effets des faibles doses, la CIPR a dès ses premières recommandations, proposé, par précaution que l’on adopte une relation entre la dose et la fréquence des cancers de forme linéaire sans seuil, bien qu’au-dessous de 1 Gy aucune observation probante n’ait pu monter que cette affirmation était vraie ou fausse. On dira donc que, quelle que soit la dose reçue, un effet est possible, même s’il n’est pas observable. On notera qu’alors que le principe de précaution n’était pas sans cesse évoqué, la CIPR à l’origine l’a utilisé.
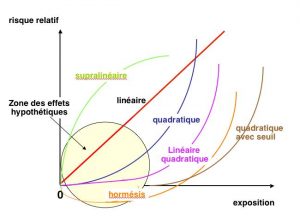
En effet, plusieurs représentations théoriques de la relation entre la dose et les effets biologiques ont été proposées (Figure 7). La relation quadratique représente pour beaucoup la relation la plus probable sur le plan biologique. La relation linéaire quadratique, voire avec seuil a été observée, par exemple après ingestion de radium pour les cancers osseux. Une relation montrant un effet d’hormésis est possible et a été décrit pour les leucémies chez les survivants des bombardements d’Hiroshima et de Nagasaki. La relation supra-linéaire n’est observée que pour des composants cellulaires. C’est pourquoi la CIPR maintient, par précaution, et pour des raisons de gestion, son choix de relation linéaire sans seuil tout en reconnaissant, dans ses dernières recommandations (Publication 103, 2007) que d’autres expressions sont possibles dans des cas particuliers. Il appartiendra alors au législateur de concilier la pratique d’une activité et son acceptabilité en termes de risques par la société. Partant d’une base scientifique, la radioprotection devra dès lors prendre en compte des facteurs sociétaux qui sont fréquemment à la base de toutes les difficultés et parfois des incompréhensions.
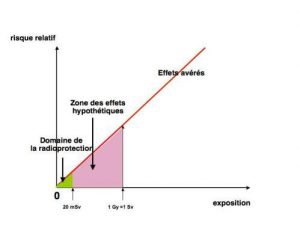
Il existe des divergences d’appréciation sur la légitimité d’extrapolation en dehors du champ couvert par les données acquises, notamment pour l’évaluation de risques résiduels imputables à de très faibles expositions, mais l’ensemble de la communauté scientifique compétente convient que, s’ils existent, ces risques ne peuvent être que très faibles, inaccessibles en fait à l’observation épidémiologique. Il apparaît donc que la zone qui intéresse la radioprotection se situe dans une zone ou aucun effet délétère n’a pu être observé (Figure 8). C’est donc bien par précaution que la CIPR a bâti ses premières recommandations.
Le temps de latence de ces cancers est très variable : 4 à 20 ans pour les leucémies, jamais inférieur chez l’adulte à 10 ans pour les autres cancers, il peut atteindre 35 à 40 ans pour les cancers digestifs. Chez l’enfant, ce temps de latence peut être considérablement diminué, comme l’a montré l’augmentation brutale de cancers de la thyroïde chez les enfants proches de la centrale de Tchernobyl durant l’accident de 1986.
5. Le système de protection radiologique
L’irradiation par les rayonnements ionisants provient de deux sources majeures, les rayonnements naturels dans lesquels l’homme baigne en permanence et les sources de rayonnement d’origine humaine, c’est-à-dire liées aux technologies modernes. Pour la plupart des pays, l’irradiation par les sources naturelles reste la plus importante et est suivie par l’irradiation médicale qui dépend étroitement du niveau technologique du pays. L’inventaire de ces irradiations est mis à jour régulièrement par le Comité scientifique des Nations Unies pour l’étude des effets des rayonnements ionisants (UNSCEAR). Pour s’en protéger un système de protection radiologique a été créé au début des années 1950 par la CIPR qui s’est principalement tournée vers les activités nucléaires et qui étend aujourd’hui son domaine de recommandations à tous les rayonnements ionisants, rappelons le, quelle que soit leur origine.
5.1. Le champ d’application
La CIPR classe les activités humaines en deux groupes. Les activités qui augmentent l’exposition aux rayonnements appelées pratiques et celles qui diminuent l’exposition totale, soit au niveau des individus soit au niveau du nombre d’individus exposés et qui sont appelées interventions. Les installations nucléaires, mais aussi les installations médicales sont classées dans les pratiques. Les actions de remédiation concernant le radon ou les actions après accidents sont des interventions.
Les dispositions réglementaires sont différentes pour les pratiques et les interventions. Les pratiques sont planifiées : on peut les accepter ou les refuser, elles sont strictement réglementées. Pour les interventions, la notion de réglementation ne s’applique plus, il appartient aux acteurs de gérer la crise et d’agir dans un concept d’optimisation adapté à la situation. Il en va de même pour l’irradiation naturelle où la décision de réduire ses effets éventuels ne peut que découler d’une décision politique optimisée en termes de santé publique, comme dans le cas du radon. Une action ne sera préconisée que si elle est gérable, par exemple, rien n’est envisagé pour diminuer la charge corporelle en potassium 40 (40K), car impossible.
Pour l’irradiation médicale enfin, la CIPR distingue bien le patient pour lequel un bénéfice individuel immédiat est attendu, et pour lequel il n’y aura pas de réglementation, mais seulement des recommandations de bonnes pratiques, et le personnel qui se verra appliquer la réglementation courante.
5.2. Les trois principes
La CIPR base son système de protection sur trois principes. Le premier principe dit de justification rappelle que l’introduction de pratiques pouvant irradier des personnes doit apporter un bénéfice net, individuel ou collectif. Il est de la responsabilité des États. Le second principe dit d’optimisation de la radioprotection demande que l’on expose le moins possible les travailleurs et les populations, compte tenu des facteurs économiques et sociaux. Il est la conséquence de l’adoption, par précaution, d’une relation linéaire sans seuil entre l’exposition aux rayonnements et les effets tardifs. Il est connu sous son acronyme anglais ALARA (As Low As Reasonably Achievable). Enfin, si une activité est justifiée et si l’optimisation est mise en place, la CIPR demande que cela ne se fasse pas au détriment d’une seule personne ou d’un petit groupe et demande qu’au niveau individuel, aucun individu ne soit exposé à un niveau de risque jugé inacceptable dans le cadre des pratiques et dans des circonstances normales, c’est le principe de limitation. L’application simultanée de ces trois principes est nécessaire. Il est fondamental que ces principes soient considérés comme un tout. Aucun d’entre eux ne peut être appliqué séparément.
Dans ses dernières recommandations (Publication 103) la CIPR renforce une notion déjà évoquée lors de ses précédentes recommandations (Publication 60), la notion de Contrainte. Ce terme d’origine anglaise (constraint) est différemment interprété selon les pays et leur langue. Pour la CIPR, la contrainte est un objectif que se fixe l’opérateur dans sa procédure d’optimisation. La valeur choisie doit être inférieure à la limite de dose. Si cette valeur, fixée en accord avec l’autorité de sûreté, est dépassée, bien qu’en deçà de la valeur limite, l’opérateur n’est pas en situation infractionnelle. Quoi qu’il en soit ce terme est mal accepté et pour beaucoup peut apporter de la confusion et conduire à l’adoption de facto d’une limite inférieure à la limite réglementaire.
5.3. Les limites de doses
Les dernières recommandations de la CIPR publiées en 2007 (ICRP 103) maintiennent les limites précédentes : de 100 mSv sur 5 ans pour les travailleurs, à condition qu’une valeur de 50 mSv ne soit pas dépassée en une seule année et une limite annuelle de 1 mSv pour le public, valeur limite qu’il ne faut pas ajouter à l’irradiation naturelle préexistante. Bien entendu cette limite n’est pas utilisée dans le domaine médical pour les patients. Pour les travailleurs, de nombreux États, notamment la France, ne reprennent pas la souplesse autorisée par la CIPR et fixent à 20mSv/an la limite annuelle pour les travailleurs exposés.
6. Quelques sujets faisant débat
Il s’agit des conséquences des accidents graves de réacteurs, de la notion de dose collective utilisée pour évaluer les conséquences de ces accidents, de la radiotoxicité associée à la gestion des déchets radioactifs et des cancers radio-induits et des prédispositions naturelles.
6.1. Les accidents de réacteurs, Tchernobyl et Fukushima
L’industrie nucléaire, depuis son essor après la seconde guerre mondiale a connu dans le monde quatre accidents majeurs de réacteurs avec relâchement de produits radioactifs pouvant affecter l’homme et l’environnement. Le premier a eu lieu en Angleterre le 16 octobre 1957 à Windscale, devenu depuis Seallafield, le second le 28 mars 1979 à Three Mile Island (TMI) en Pennsylvanie (USA), le troisième le 28 avril 1986 à Tchernobyl (Ukraine) et le dernier le 11 mars 2011 à Fukushima au Japon (Lire : Nucléaire, retour d’expérience sur les accidents).
Les types de réacteurs étaient tous différents, les causes des accidents diverses, un relâchement brutal de l’énergie accumulée dans le graphite (Effet Wigner) à Windscale, le blocage d’une soupape de sécurité mal interprété par les opérateurs à TMI, un essai de sûreté réalisé dans des conditions surréalistes sur un réacteur sans enceinte de sécurité à Tchernobyl et la perte des systèmes de réfrigération des réacteurs après leur arrêt automatique lié au séisme au Japon suite à la vague géante du Tsunami (environ 14 mètres alors que les réacteurs avaient été conçu pour résister à une vague de 5,7 m).
À Fukushima, les explosions n’ont pas eu lieu dans le cœur du réacteur mais dans l’enceinte de confinement suite à un dégagement d’hydrogène, l’une d’elle ayant endommagé la cuve du réacteur, expliquant ainsi le relâchement de radionucléides.
6.1.1. Mortalité par syndrome d’irradiation aigue (ARS)
À Tchernobyl, deux personnes sont décédées suite à l’explosion du réacteur. Le nombre de personnes victimes d’ARS durant les premières années a été estimé à l’origine à 237 cas. Après des analyses cliniques détaillées ce nombre a été ramené à 134 cas. Parmi ceux ci, 28 sont morts dans le mois qui suivit l’accident, 19 dans les années 1987-2004. Aucun ARS n’a été observé à Fukushima.
6.1.2. Les cancers de la thyroïde.
Quelques années après l’accident de Tchernobyl, une augmentation considérable des cancers de la thyroïde a été observée chez l’enfant. L’irradiation de la thyroïde est liée à l’inhalation d’iode radioactif pendant la diffusion du panache mais également à la consommation de lait frais contaminé avant que des contre-mesures ne soient décidées.
En 2010, le nombre de cancers de la thyroïde observé chez l’enfant était de 5.127 cas si l’on prend la fourchette 0 à 14 ans et 6.848 cas avec la fourchette 0-18 ans. Ces chiffres sont à comparer avec ceux d’une occurrence de 2 à 4 par million et par an pour une population non contaminée. Les premiers sont apparus 5 ans après l’accident et l’augmentation a persisté jusqu’en 2005. Quinze enfants sont décédés des suites de ces cancers. Pour les enfants nés après 1986, aucune augmentation du taux de cancers n’a été observée, l’iode radioactif ayant disparu. L’UNSCEAR estime que cette augmentation est également due à l’augmentation de la surveillance et l’amélioration des techniques diagnostiques.
On note une augmentation significative des cancers de la thyroïde chez les adultes exposés à l’iode radioactif parmi les résidents des zones contaminées. Mais fort curieusement on observe une augmentation du taux de cancer avec la dose chez la femme, mais une diminution chez l’homme. Ce résultat paradoxal laisse penser à un biais introduit par le dépistage.
Ces cancers seront moindres à Fukushima car des contre-mesures ont été prises. Elles consistent à ingérer des pastilles d’iode non radioactif qui, saturant un moment la thyroïde, empêche la capture d’isotopes radioactifs. Il existe en effet une différence importante entre Fukushima et Tchernobyl. A Tchernobyl, l’accident a relâché instantanément une grande partie de radionucléides, au Japon le relâchement de radionucléides ne s’est pas fait instantanément ce qui a laissé aux autorités le temps d’organiser des contre-mesures.
En France, la conception des réacteurs donne le temps aux autorités pour distribuer des pastilles d’iode en cas d’accident grave. La distribution des comprimés d’iode non radioactif, serait décidée par les autorités de sûreté si elles estiment que la dose reçue par la thyroïde peut dépasser 50 mGy. La prise ne doit en aucun cas être faite avant le signal des autorités car leur efficacité maximale (totale) intervient 2 à 3 heures jusqu’à ½ heure avant l’incorporation d’iode radioactif et que son efficacité redevient faible 48 heures après. Si la contamination persistait, les autorités pourraient recommander une seconde prise d’iode stable, probablement à des doses plus faibles.
6.1.3. Les autres cancers
Les doses reçues par les liquidateurs de Tchernobyl (nom donné à toutes les personnes qui sont intervenues pour traiter les conséquences de l’accident) sont aujourd’hui estimées pour la période 1986-1990 à 120 mSv en moyenne. La dose reçue par les six millions de personnes résidant dans la zone contaminée a été estimée pour la période 1986-2005 à environ 9 mSv. Pour environ 150.000 d’entre elles, la dose reçue pendant ces vingt années a été de 50 mSv. Pour les 98 millions d’habitants des trois républiques la dose effective moyenne est de 1,3 mSv, un tiers ayant été reçu la première année. Pendant la même période l’irradiation naturelle (environ 2,4 mSv/an en moyenne) a délivré pour cette population environ 50 mSv soit autant ou plus que la dose liée à l’accident. Pour les 500 millions d’européens la dose moyenne est estimée à 0,3 mSv pendant cette période de 20 ans.
L’UNSCEAR rappelle très clairement l’influence d’autres facteurs, tel le stress, pouvant influencer l’état de santé des populations affectées par la catastrophe. Il est clair que cela entretient une polémique toujours vive, certains attribuant toute pathologie post-Tchernobyl au seul effet des rayonnements.
6.1.4. Les leucémies
Leur temps de latence est faible et elles devraient déjà être toutes observées. Une forte augmentation de leucémies était particulièrement redoutée chez l’enfant, elle devait apparaître tôt et ne pas persister après 15-20 ans. En fait, l’UNSCEAR déclare en 2011 que chez l’enfant une faible augmentation ou pas d’augmentation du tout, décrit au mieux la situation dans les territoires contaminés. La situation est toutefois contrastée selon les républiques; l’Ukraine décrit une augmentation, faible, avec la dose, la Biélorussie et la Russie n’en décrivent aucune. La dose à la moelle osseuse étant faible (moins de 10 mGy), l’UNSCEAR estime qu’il n’existe pas d’évidence convaincante d’une augmentation de leucémies chez l’enfant suite à l’accident de Tchernobyl et qu’aucune augmentation significative ne peut raisonnablement être démontrée par l’épidémiologie.
Chez l’adulte, une étude datant de 1996 portant sur 142.000 liquidateurs russes, rapporte 48 leucémies (leucémie lymphatique chronique) pour la période 1986-1993. Comparée à la population en général, l’augmentation d’un facteur 1,77 pour cette étude, est du même ordre que ce qui a été observé parmi les survivants d’Hiroshima et de Nagasaki. Le rapport note que le nombre de cas de leucémies a pu être faussé par une attention médicale accrue pour ces travailleurs.
6.1.5. Les autres cancers
Il apparaît aujourd’hui qu’on ne note pas d’augmentation vraiment significative des autres cancers parmi les populations de Russie et d’Ukraine. On ne note aucune différence entre les habitants des territoires contaminés ou pas.
Parmi les liquidateurs, des résultats contradictoires existent. Certains groupes présentent une augmentation mais aucune corrélation avec la dose n’est établie. À l’inverse, deux études russes montrent une relation du taux de mortalité avec la dose suite à des cancers solides. Il faut toutefois rester prudent sur l’interprétation de ces résultats car il est difficile de comparer la population des liquidateurs à la population en général car les liquidateurs ont eu un suivi médical (un examen par an) que n’a pas eu la population en général. Enfin, si l’on se rapporte à la population des survivants des bombardements d’Hiroshima et de Nagasaki, les doses (comparables au rayonnement naturel) sont trop faibles pour qu’un effet soit observé.
À Tchernobyl, il existe d’autres caractéristiques de ces populations que sont la consommation tabagique et l’alcoolisme conduisant pour la population masculine en Russie à une espérance de vie inférieure, d’environ 15 années, à celle d’autres pays occidentaux et tout particulièrement du Japon.
6.1.6. Les maladies non cancéreuses
Parmi les personnes souffrant de syndrome aigu d’irradiation plusieurs études ont révélé une opacité du cristallin (cataracte) pour des doses de 0,5 Gy, très inférieures aux observations antérieures. C’est un rare point, avec les cancers de la thyroïde chez l’enfant où les observations sont assez concluantes. Ces résultats ont conduit la CIPR à réviser la limite de dose pour le cristallin.
On sait depuis très longtemps que l’irradiation du cœur à forte dose en radiothérapie, conduit à des maladies cardiovasculaires. Par contre, il n’y a pas d’augmentation avérée suite aux faibles doses dues à l’accident de Tchernobyl. Enfin, aucune augmentation des malformations congénitales n’a été observée
6.1.7. Projections et conclusions pour les décideurs après l’accident de Tchernobyl
Le rapport UNSCEAR 2011 s’adressant aux décideurs rappelle :
– qu’il n’y a pas d’effets déterministes dus aux radiations parmi les populations ;
– que l’augmentation de l’incidence de cancers due aux rayonnements n’est pas suffisamment significative pour justifier l’organisation d’un système de santé publique, bien que pour certains groupes limités, la poursuite d’études épidémiologiques puisse se justifier ;
– que l’augmentation du risque de cancer de la thyroïde peut se poursuivre, notamment pour les personnes exposées durant leur enfance ;
– que le traumatisme psychologique causé par cet accident peut affecter des millions de personnes, cette pathologie étant vraisemblablement la plus importante retrouvée dans toutes les catastrophes de grande ampleur.
Le rapport rappelle également que c’est au dessus de 0,1 Sv que l’on note une augmentation de l’incidence de cancers et que les nombreuses études effectuées de par le monde parmi les populations ayant reçu des doses plus faibles ont toutes échoué. Quant à l’Europe, la dose reçue par cet accident, de 30 mSv sur 20 ans, ne justifie en aucun cas la mise en œuvre d’études épidémiologiques.
En conclusion, si l’on prend les coefficients de risque de la CIPR, basés sur la relation linéaire sans seuil, qui ne tient pas compte du fait, unanimement reconnu par les scientifiques, que l’on n’observe aucun cancer en dessous de 100 mSv, Tchernobyl pourrait être la cause de 2.500 cancers mortels. Un forum international sous l’égide d’organisations de l’ONU avançait par prudence en 2005 un chiffre maximum de 4.000. Mais compte tenu des incertitudes, il était possible d’avancer une fourchette de 0 à 4.000. Ces propos, qualifiés par certains de méprisants ou d’indécents vis à vis des victimes, ont soulevé un tollé général parmi les opposants au nucléaire. Et par souci d’apaisement le chiffre de 4.000 a été maintenu.
À Fukushima, certains experts avancent aujourd’hui, compte tenu des doses reçues, que le nombre de cancers pourraient atteindre, au maximum une centaine de cas. Ce chiffre est à comparer aux plus de 20.000 morts liés au tsunami. Afin de rassurer les populations, les autorités japonaises ont décidé de lancer une gigantesque étude épidémiologique sur les personnes affectées par l’accident. La communauté scientifique, approuve cette démarche car elle permet de restaurer la confiance parmi ces populations.
Si l’aspect sanitaire pour Fukushima peut être considéré comme probablement assez faible, il n’en sera rien pour l’agriculture et l’environnement car une partie du territoire proche de la centrale sera, comme pour Tchernobyl, soustrait aux pratiques agricoles. Sur la base de mesures effectuées entre mai et juillet 1986, environ 130.000 ha ont été initialement exclus d’une production agricole en Biélorussie, 17.300 en Russie et 57.000 en Ukraine. Fin 1986, 80% des productions agricoles provenant des oblasts les plus contaminés étaient au dessus des niveaux d’intervention. En 1991, la radioactivité de moins de 0,1% des céréales dans les trois républiques restait en dessus de 370 Bq/kg. Enfin, certaines espèces de colza, captent 2 à 3 fois moins de 137Cs que la plupart des végétaux. Ainsi la culture du colza a été multipliée par 4 dans les zones contaminées.
Les réactions suite à ces deux accidents montrent bien qu’il est toujours difficile aujourd’hui de s’entendre sur ce qu’est réellement le risque nucléaire. Il faut rappeler, si l’on s’en tient à la seule situation française, que nos routes ont tué en 2013, selon les chiffres de la Sécurité Routière, 2.943 personnes. La comparaison avec une autre énergie, le charbon, est tout aussi parlante, les autorités chinoises rapportaient pour l’année 2009, 2.631 décès accidentels dans les mines chinoises, se félicitant d’une baisse de 18% par rapport à l’année précédente. Alors, le risque nucléaire justifie-t-il l’arrêt de l’utilisation de cette source d’énergie, avec ses conséquences probables sur la production de CO2 et en matière de changement climatique ?
6.2. La dose collective
La dose collective est une dose reçue par une population définie comme la somme de toutes les doses efficaces reçues par les membres de cette population. On l’exprime en homme.sievert (hSv). Utile pour l’optimisation et le choix d’options technologiques, elle n’est en aucun cas un outil de radioprotection mais elle renseigne sur la qualité de la radioprotection au niveau d’une installation.
La CIPR, dans ses dernières recommandations, a clairement rappelé qu’elle ne devait en aucun cas être utilisée pour des études épidémiologiques. Elle a rappelé également qu’elle ne devait pas être utilisée pour calculer le nombre de cancers dus aux expositions de grandes populations à des expositions très faibles, comme certains l’ont fait après l’accident de Tchernobyl. Elle dit également qu’elle ne peut être utilisée sur des échelles de temps trop importantes, comme par exemple la gestion de déchets radioactifs sur 1 million d’années.
6.3. La radiotoxicité.
La radiotoxicité d’un radionucléide se définit actuellement en termes de dose efficace engagée que recevra un individu, suite à l’incorporation d’un radionucléide. La dose par unité d’incorporation (DPUI) est exprimée en Sv par Bq. Plus la DPUI sera élevée, plus le radionucléide sera considéré comme radiotoxique. Son calcul, nous l’avons vu, tient compte de la période radioactive du radionucléide, de l’énergie de son émission, et de sa période biologique. La DPUI peut également varier avec l’âge car, à activité incorporée égale, elle est supérieure chez le très jeune enfant.
Une donnée physique est trop souvent oubliée lors de la comparaison de la radiotoxicité des radionucléides : l’activité spécifique. Elle est, par définition, inversement proportionnelle à la période : plus la période est courte, plus la radioactivité par unité de masse est grande. Ceci a été illustré tragiquement avec l’assassinat d’Alexandre Litvinenko en novembre 2006. Ses assassins ont utilisé du 210Po, sachant qu’un microgramme de 210Po émet autant de particules alpha que 4,5 mg de 226Ra, 72 mg de 239Pu ou 4,46 kg de 238U, il est donc plus facile pour un tel acte criminel d’utiliser l’isotope ayant la plus forte activité spécifique. De plus les auteurs de cet assassinat, parfaits connaisseurs de la radiotoxicologie, se sont souvenus qu’en plus de l’activité spécifique, favorable au 210Po, son incorporation au niveau intestinal est de 50%, alors qu’elle n’est que 0,01% seulement pour le plutonium.
Il faut enfin rappeler que le Bq, unité de radioactivité, n’est en rien une unité de risque comme le montre la Figure 9 ; pour un même Bq ingéré la dose efficace engagée délivrée pour un même individu peut varier de plusieurs ordres de grandeur (Figure 9).
6.4. Cancer radio-induit et prédisposition génétique
La question de la prédisposition génétique aux cancers induit par les radiations, et en particulier celles des travailleurs, est un sujet de préoccupation pour la radioprotection car elle risque de devenir un des grands sujets de la radioprotection, dans la mesure où elle peut avoir un impact sur les politiques nationales en matière d’emploi, d’assurance et d’indemnisation.
Aujourd’hui, par exemple, les sujets porteurs atteints d’ataxie-télangectasie (maladie génétique rare se caractérisant par des signes neurologiques avec une démarche instable et des mouvements oculaires désordonnés) ont une sensibilité aigue aux rayonnements ionisants. D’autres recherches sont en cours, mais les résultats scientifiques sont difficiles à interpréter et n’apparaissent qu’à des doses élevées relevant plus de la radiothérapie que de la radioprotection. Toutefois il faut attirer l’attention sur la question d’éventuels tests pour détecter la prédisposition génétique et surtout sur leur fiabilité. De plus, comme pour d’autres secteurs d’activités, l’hypothèse d’une éventuelle sélection génétique qui pourrait en découler soulève des problèmes éthiques et sociaux considérables. Aujourd’hui la CIPR rejette cette notion pour la radioprotection.
Conclusion
Le système de radioprotection basé sur deux concepts, la dose équivalente et la dose efficace (qui permettent de comparer les effets de tous les rayonnements), ainsi que sur trois principes est un système qui permet de manière relativement simple, et malgré ses incertitudes, une gestion dans les laboratoires et usines de la radioprotection. Il paraît difficile de le remettre en cause. Ses qualités ont été, au grand bien des patients, exportées à la pratique médicale. Les résultats des cinquante dernières années montrent qu’il est opérationnellement fiable. Il n’en demeure pas moins que pour les faibles doses, inférieures aux limites règlementaires, existe toujours un débat sur son coût, car basé sur des extrapolations à des niveaux où l’on ne pourra jamais en vérifier le réel bénéfice. À l’ origine fondée sur la science, ce système est aujourd’hui conduit par une approche sociétale que l’on retrouve partout dès lors que l’on parle de précaution et de faibles doses.
La conclusion est que le paradigme sur lequel se fonde la réglementation actuelle semble, aux yeux du plus grand nombre, le plus mûr et le mieux accepté par la majorité du monde scientifique et du monde sociétal. Ce système, et les limites de doses réglementaires qu’il introduit, ne semblent pas devoir être remis en cause dans la décennie prochaine par de nouveaux résultats scientifiques. En effet, le système de radioprotection a largement anticipé les progrès des connaissances, car il était évident, par exemple, qu’on ne pouvait attendre d’avoir tous les enseignements du suivi médical des survivants d’Hiroshima-Nagasaki pour bâtir un système de radioprotection fiable.
Notes et références
[1] Soit la commission internationale des unités et mesures radiologiques et la commission internationale de protection radiologique (CIPR).
Bibliographie complémentaire
Académie des sciences (2011), L’accident majeur de Fukushima, Considérations sismiques, nucléaires et médicales, Edp sciences, Les Ulis.
Chelet Y. La radioactivité, manuel d’initiation, Nucléon, Les Ulis, 2006.
Delacroix D., Guerre J.P., Leblanc P. Guide pratique Radionucléides & Radioprotection, Deuxième édition, Edp Sciences, Les Ulis, 2006.
International Atomic Energy Agency (IAEA), Chernobyl’s legacy : health, environmental and socio-economic impacts, and Recommendations to the Governments of Belarus, the Russian federation and Ukraine, IAEA, Vienne, 2005.
ICRP (1991), 1990 recommendations of the International Commission on Radiological Protection, ICRP Publication 60, Annals of the ICRP, 21,1-3, Pergamon Press Oxford
ICRP (2006), Low-dose extrapolation of radiation-related cancer risk. ICRP Publication 99, Annals of the ICRP Elsevier, Amsterdam.
ICRP (2007), ICRP Publication 103, 2007 recommendations of the International Commission on Radiological Protection, Elsevier, Amsterdam
Institut National de Veille Sanitaire (INVS) (2007), Exposition de la population française aux rayonnements ionisants liée aux actes de diagnostic médical en 2007, rapport INVS-IRSN.
IRSN (2011), La radioprotection des travailleurs. Exposition professionnelle aux rayonnements ionisants en France: bilan 2012. Rapport IRSN/PRP-HOM/2013-008.
IRSN (2014), Accident à la centrale de Fukushima Daiichi, Cinq dossier accessibles sur site www.irsn.fr
Jimonet C., Métivier H. Personne compétente en radioprotection, principes de radioprotection-réglementation, 2nd édition, EDP Sciences, Les Ulis, 2009
Métivier H ; coordinateur (2006), Radioprotection et ingénierie nucléaire, EDP sciences, Les Ulis, 2006.
Métivier H ; (2012), Contamination interne et Toxicologie, RG N °4 Juillet août 2012
Tubiana M.(2008), Radiobiologie, Radiothérapie et Radioprotection, Bases fondamentales, Hermann médecine, Paris, 2008 ;
Smith J, Beresford N.A. (2005), Chernobyl- Catastrophe and consequences, Springer, Berlin (2005)
Union Européenne : directive du conseil 2013-59 fixant les normes de base relatives à la protection sanitaire contre les dangers résultant de l’exposition aux rayonnements ionisants et abrogeant les directives 89/618/Euratom, 90/641/Euratom, 96/29/Euratom, 97/43/Euratom et 2003/122/Euratom
UNSCEAR (2008), UNSCEAR 2006 report to the United nations general assembly. Volume I , Annex A ; Epidemiological studies of radiation and cancer. Annex B. Epidemiological evaluation of cardiovascular disease and other non-cancer diseases following radiation exposure. United Nations, New York.
UNSCEAR (2010), UNSCEAR 2008 report to the United nations general assembly. Volume I : sources. Annex A. Medical radiation exposures, Annex B.exposures of the public and workers from various sources of radiation. United Nations, New York.
UNSCEAR (2011), UNSCEAR 2008 report to the general assembly. Volume II, Annex C. radiation exposures in accidents, Annex D. Health effects due to radiation from the Chernobyl accident, Annex E, Effcts of ionizing radiation on non-human biota. United Nations, New York.
UNSCEAR (2013), UNSCEAR 2013 report to the general assembly. Volume I, Annex A. levels and effects of radiation exposure due to the nuclear accident after the 2011 great east-Japan earthquake and tsunami. United Nations, New York.
OCDE/AEN (2007), Scientific Issues and Emerging Challenges for Radiological Protection. Report of the Expert Group on the Implications of Radiological Protection Science. OECD, Paris.
Autres sources d’informations :
Institut de radioprotection et de sureté nucléaire : www.irsn.fr
Autorité de sureté nucléaire : www.asn.fr
Société française de Radioprotection : www.sfrp.asso.fr
Institut national de recherche en sécurité : www.inrs.fr
Institut national de veille sanitaire: www.invs.sante.fr
ICRP : www.icrp.org
IAEA : www.iaea.org
OCDE-AEN : www.oecd-nea.org
L’Encyclopédie de l’Énergie est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article, merci de mentionner le nom de l’auteur, le titre de l’article et son URL sur le site de l’Encyclopédie de l’Énergie.
Les articles de l’Encyclopédie de l’Énergie sont mis à disposition selon les termes de la licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Pas de Modification 4.0 International.