La transformation de l’énergie chimique des aliments en énergie musculaire est à la base de toutes les fonctions vitales. Comment s’opère-t-elle ? En quoi consistent la conversion cellulaire de l’énergie et l’utilisation cellulaire de l’adénosine triphosphate (ATP) ?
Comme les autres espèces animales, et contrairement aux espèces végétales chlorophylliennes qui sont autotrophes [1] (Lire : Photosynthèse et biomasse) ou à certaines bactéries chimiotrophes [2], l’Homme est hétérotrophe [3]. L’énergie qu’il utilise est donc celle qui dérive des substances organiques présentes dans les aliments, d’origine animale ou végétale, qu’il consomme. Ceux-ci lui apportent de l’énergie chimique qu’il transforme sous d’autres formes, notamment en travail (énergie mécanique), pour assurer ses fonctions vitales (Lire : Qu’est-ce que l’énergie ?). Si on excepte les minéraux, les éléments traces, ou les vitamines qui ne sont pas directement impliqués dans l’énergétique cellulaire, les aliments sont tout d’abord absorbés, puis dégradés au niveau du système digestif en toute une série de composés qui appartiennent à l’un ou l’autre des trois grands groupes que sont les lipides, les protéines, ou les glucides.
1. Bases de la transformation de l’énergie chimique dans le « milieu intérieur » du corps
Tout au long du tube digestif, des cellules sécrétrices libèrent des enzymes digestives et du mucus qui vont permettre la digestion chimique des différents aliments et leur transformation en nutriments élémentaires. Ainsi, l’amidon, composant principal des féculents et réserve d’énergie, est dégradé par des amylases salivaires et pancréatiques en sucres simples, tandis que les protéines sont découpées par des enzymes protéolytiques gastriques en petits peptides, qui sont ensuite hydrolysés dans le duodénum en acides aminés élémentaires par des peptidases pancréatiques.
La quasi-totalité de ces nutriments est absorbée au niveau des cellules entérocytaires de l’intestin grêle qui présentent de très nombreuses villosités et microvillosités membranaires leur conférant une remarquable capacité d’absorption. Les glucides, absorbés sous forme de sucres simples, et les protéines, absorbées sous forme d’acides aminés ou de petits peptides élémentaires, passent ensuite dans le sang pour atteindre l’ensemble des organes. Les lipides sont absorbés sous différentes formes puis dégradés en un mélange d’acides gras, de mono- et de di-glycérides, de phospholipides, de glycérol et de cholestérol, par des mécanismes complexes impliquant des sels biliaires et diverses enzymes pancréatiques (lipases et phospholipases). Ils sont ensuite estérifiés en triglycérides et sécrétés sous forme de chylomicrons dans le système lymphatique, puis dans le sang. Ces processus permettent de délivrer à l’ensemble des cellules de l’organisme des composés qui vont permettre aux différents tissus de produire, à partir de l’énergie chimique apportée par les nutriments, d’autres formes d’énergies.
Dans le règne animal, le mode le plus important de transformation d’énergie est la transformation de l’énergie chimique en mouvement et en travail mécanique. Celle-ci implique des mécanismes précis, ordonnés et constamment régulés en fonction des besoins de l’organisme, qui se déroulent dans le « milieu intérieur ».
Claude Bernard a exposé sa conception du « milieu intérieur » dans un ouvrage posthume intitulé Leçons sur les phénomènes de la vie communs aux animaux et aux végétaux (1878-1879). Selon lui :
« La vie constante ou libre est la troisième forme de la vie : elle appartient aux animaux les plus élevés en organisation… Les organes, les appareils, les tissus, fonctionnent d’une manière sensiblement égale, sans que leur activité éprouve ces variations considérables qui se montraient chez des animaux à vie oscillante. Il en est ainsi parce que le « milieu intérieur » qui enveloppe les organes, les tissus, les éléments de tissus, ne change pas; les variations atmosphériques s’arrêtent à lui de sorte qu’il est vrai de dire que les « conditions physiques du milieu » sont constantes pour l’animal supérieur; il est enveloppé dans un milieu invariable qui lui fait comme une atmosphère propre dans le milieu cosmique toujours changeant… Je crois avoir le premier insisté sur cette idée qu’il y a pour l’animal réellement deux milieux : un milieu extérieur dans lequel est placé l’organisme, et un milieu intérieur dans lequel vivent les éléments des tissus. L’existence de l’être se passe, non pas dans le milieu extérieur, air atmosphérique pour l’être aérien, eau douce ou salée pour les animaux aquatiques, mais dans le milieu liquide intérieur formé par le liquide organique circulant qui entoure et où baignent tous les éléments anatomiques des tissus; c’est la lymphe ou le plasma, la partie liquide du sang, qui, chez les animaux supérieurs, pénètrent les tissus et constituent l’ensemble de tous les liquides interstitiels, expression de toutes les nutritions locales, source et confluent de tous les échanges élémentaires…
La fixité du milieu intérieur est la condition de la vie libre et indépendante… le mécanisme qui le permet est celui qui assure, dans le milieu intérieur, le maintien de toutes les conditions nécessaires à la vie des éléments. Dans la vie constante, l’être vivant paraît libre et les manifestations vitales semblent produites et dirigées par un principe vital intérieur affranchi des conditions physiques ou chimiques extérieures. Cette apparence est une illusion. Tout au contraire, c’est particulièrement dans le mécanisme de la vie constante ou libre que ces relations étroites se montrent dans leur pleine évidence. » [4]
Dans les paragraphes suivants, nous envisagerons les mécanismes physiologiques cellulaires qui permettent aux espèces animales, en utilisant les composés organiques contenus dans leur alimentation, de disposer dans leur milieu intérieur d’une énergie chimique potentielle, et les mécanismes qu’elles mettent en jeu pour utiliser cette énergie chimique pour assurer les différents mécanismes énergie-dépendants et les différentes fonctions indispensables à leur survie (mouvement, chaleur, travail, phénomènes électriques, lumière etc.) À cette fin, nous aborderons en premier lieu l’étape de conversion cellulaire de l’énergie au cours de laquelle le catabolisme des différents substrats métaboliques apportés par l’alimentation permet aux cellules animales de produire des composés riches en énergie. Puis nous envisagerons ensuite une seconde étape, celle au cours de laquelle ces composés riches en énergie vont être utilisés pour couvrir les besoins énergétiques des différentes fonctions cellulaires. L’exemple de la contraction musculaire sera plus particulièrement développé.
2. Conversion cellulaire de l’énergie
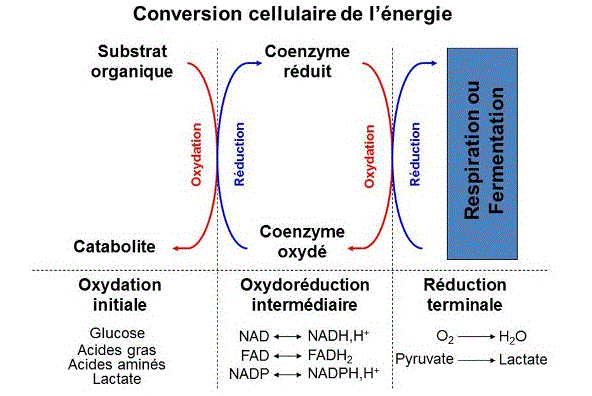
Au niveau cellulaire, la conversion de l’énergie des substrats organiques exogènes en liaisons anhydres phosphoriques facilement utilisables par les cellules pour l’ensemble des réactions du métabolisme nécessite une série de réactions d’oxydo-réduction (Figure 1) localisées dans différents compartiments sub-cellulaires (membrane plasmique, cytosol, peroxysome, mitochondrie).
2.1. Captation cellulaire et substrats énergétiques
Parmi les substrats énergétiques ayant un rôle dans le métabolisme cellulaire, il se retrouve le glucose et les lipides (acides gras), tous deux issus de l’alimentation.
2.1.1. Le glucose
Les glucides alimentaires (glycogène, amidon) sont hydrolysés dans le tractus digestif grâce à des enzymes de type amylases, glycosidases et oligosidases. Seuls les monosaccharides issus de cette hydrolyse sont absorbés par l’épithélium de l’intestin grêle (duodénum, jéjunum). Le glucose est une molécule très hydrophile. Sa concentration dans le milieu intérieur (glycémie) est une variable physiologique très finement contrôlée. Chez l’homme, elle varie entre 3,5 mM (0,63 g/L) à l’état post-absorptif (jeûne nocturne) et 10 mM (1,8 g/L) à l’état post-prandial. Alors que le glucose issu de l’alimentation est capté par les entérocytes vers le milieu intérieur grâce à des transporteurs actifs (les SGLT, Sodium Glucose Transporters), les échanges de glucose entre le milieu intérieur et le milieu cellulaire sont essentiellement assurés par une grande famille de protéines transmembranaires, les GLUTs (Glucose Transporters). Les GLUTs assurent un transport facilité (transport passif), bidirectionnel et saturable du glucose. Immédiatement après l’étape de captation, le glucose subit une réaction de phosphorylation catalysée soit par une glucokinase (hépatocyte), soit par une hexokinase (adipocyte et cellule musculaire) :
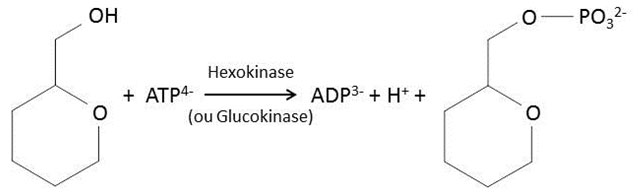
Dans le muscle et dans le tissu adipeux, cette réaction de phosphorylation qui conduit à la production de glucose-6-phosphate est très rapide et permet d’entretenir un gradient transmembranaire de glucose toujours favorable à sa captation.
2.1.2. Les lipides
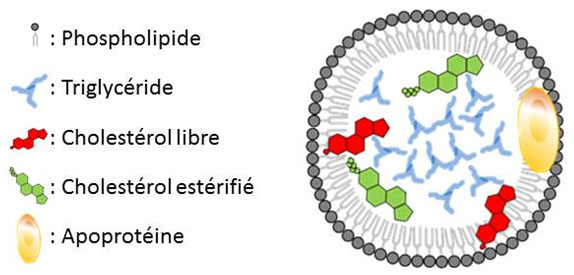
Le transport des lipides vers les différents tissus de l’organisme se fait grâce à différents complexes lipoprotéiques.
Dans le sang, les acides gras libres (non estérifiés) sont complexés à l’albumine. Les triglycérides, également appelés acides gras estérifiés ou encore triacylglycérol, sont transportés dans des gouttelettes, appelées apolipoprotéines (Figure 2). Les apolipoprotéines sont délimitées par une monocouche de phospholipides et assurant également le transport du cholestérol libre et de diverses vitamines hydrophobes (vitamine A, Vitamine E, etc…). Des protéines de surface, les apoprotéines, assurent l’adressage de ces structures de transport vers les cellules cibles.
Les chylomicrons et les VLDL (Very Low Density Lipoprotein) sont des lipoprotéines riches en triglycérides qui transportent les lipides, d’origine alimentaire ou synthétisés par le foie, jusqu’aux tissus périphériques.
Au niveau des cellules utilisatrices, les lipoprotéines sont rapidement métabolisées par la lipoprotéine lipase, enzyme qui est accrochée à la face externe de la membrane cellulaire des cellules épithéliales, des adipocytes et des cellules musculaires.
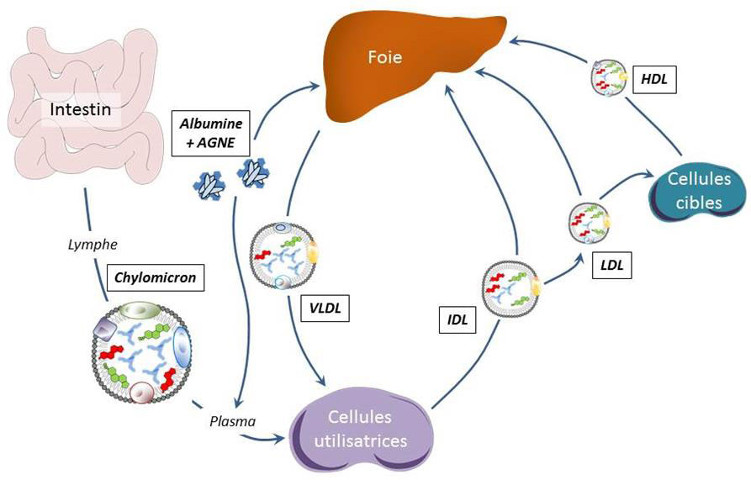
L’hydrolyse des triglycérides libère des acides gras libres qui sont alors soit stockés, soit oxydés pour la production d’énergie. Les VLDL deviennent progressivement des IDL (Intermediary Density Lipoprotein), puis des LDL (Low Density Lipoprotein) au fur et à mesure qu’elles perdent des triglycérides et s’enrichissent en phospholipides et esters de cholestérol (Figure 3).
Le mécanisme par lequel les acides gras entrent dans les cellules est encore actuellement sujet à controverse [5]. Certaines études mettent l’accent sur le transport médié par des protéines membranaires spécifiques, autres sur la capacité des acides gras protonés (électriquement neutres) de basculer de la face externe à la face interne de la membrane par un mécanisme de « flip flop » [6]. Dans les deux cas, les acides gras doivent être pris en charge à l’intérieur de la cellule afin d’éviter leur rétrodiffusion. Une enzyme périmembranaire, l’acyl-CoA synthétase (ACS) catalyse la réaction d’activation des acides gras selon la réaction :
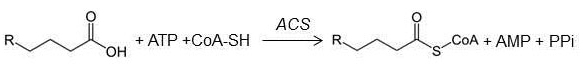
Les acyl-CoA et les acides gras libres sont ensuite pris en charge dans le cytosol par des protéines spécifiques comme l’ACBP (Acyl-CoA Binding Protein) et la FABP (Free-Fatty Acid Binding Protein), en fonction de la longueur de leur chaîne hydrocarbonée [7].
2.2. Synthèse de l’acétyl-CoA
L’acétyl-CoA constitue le point de confluence des voies métaboliques de dégradation du glucose et des acides gras. Il a une double origine : la dégradation des molécules de glucose-6-phosphate issues des glucides via la glucolyse et la dégradation des acyl-CoA issus des lipides via la beta-oxydation.
2.2.1. À partir du glucose-6-phosphate
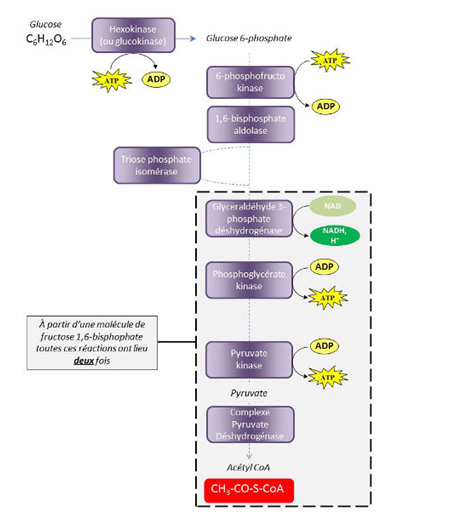
L’oxydation cytosolique d’une molécule de glucose-6-phosphate aboutit à la production nette de trois molécules d’adénosine triphosphate (ATP) (quatre produites et une consommée) et de deux molécules de pyruvate, ainsi qu’à la réduction de deux molécules de NAD (Figure 4). Les deux premières réactions de la glycolyse, qui aboutissent à la production du fructose 1,6-bisphosphate, consomment de l’ATP. Cet hexose di-phosphate est ensuite clivé en deux trioses phosphates (le glycéraldéhyde 3-phosphate et le dihydroxyacétone-phosphate), une réaction d’isomérisation catalysée par une triose phosphate isomérase permettant la conversion du dihydroxyacétone phosphate en glycéraldéhyde 3-phosphate. Au cours des étapes suivantes, les deux molécules de glycéraldéhyde 3-phosphate produites à partir d’une molécule de glucose vont permettre la production de deux acétyl-CoA et de quatre ATP, ainsi que la réduction de deux NAD en NADH,H+.
La réoxydation du NADH,H+ en NAD a lieu, en conditions normoxiques, dans la mitochondrie où le pouvoir réducteur est transporté par le biais d’une navette malate/aspartate. En conditions anaérobies, ce processus peut avoir lieu au niveau cytosolique par une réaction de fermentation au cours de laquelle, le pyruvate est oxydé en lactate par une enzyme, la lactate déshydrogénase. Dans ces conditions on parle de glycolyse anaérobie car ce processus est indépendant de la réduction mitochondriale d’oxygène en eau.
La synthèse d’acétyl-CoA à partir du pyruvate issu de l’oxydation cytosolique du glucose-6-phosphate est réalisée dans la matrice mitochondriale par une réaction de décarboxylation oxydative catalysée par un complexe constitué de trois enzymes, le complexe pyruvate déshydrogénase (PDC).
2.2.2. À partir des acyl-CoA
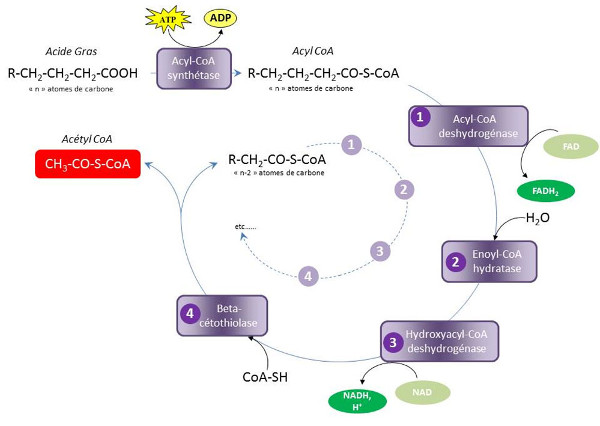
Le système de transport des Acyl-CoA à longue chaîne (jusqu’à 18 atomes de carbone) vers la matrice mitochondriale nécessite l’intervention de la L-carnitine. Les acides gras qui présentent une chaîne hydrocarbonée supérieure à 18C doivent être préalablement raccourcis grâce à la b-oxydation peroxysomale.
Lors de la b-oxydation, les Acyl-CoA sont métabolisés dans la matrice mitochondriale par une série de 4 réactions constituant ce que l’on appelle un tour d’hélice de Lynen (Figure 5). Après son activation en acyl-CoA, un acide gras libre à n atomes de carbones subit successivement une première déshydrogénation (1), une hydratation (2), une seconde déshydrogénation (3) et une thiolyse (4) conduisant à la production d’un acétyl-CoA et d’une molécule d’acétyl-CoA, un NADH,H+ et un FADH2. À l’issue de ces quatre réactions, qui constituent un tour d’hélice, l’acyl-CoA initial, raccourci de deux atomes de carbone, peut intégrer un nouveau tour d’hélice.
2.3. Utilisation mitochondriale de l’Acétyl-CoA
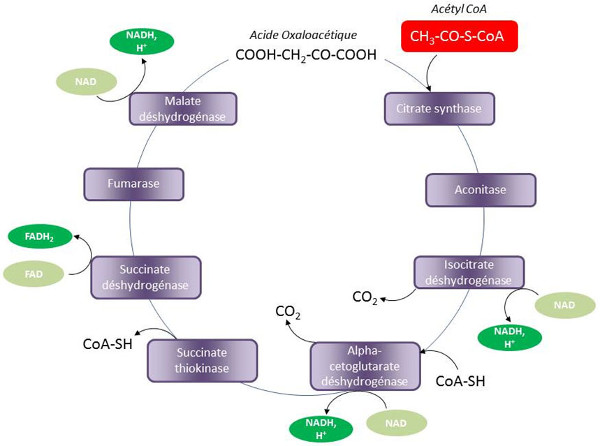
L’acétyl-CoA constitue le point de confluence des voies métaboliques de dégradation du glucose et des acides gras. Cette molécule est de plus un puissant effecteur allostérique du complexe PDC qu’elle inhibe.
Dans la matrice mitochondriale, le groupement acétyl de l’acétyl-CoA est transféré sur l’oxaloacétate pour former du citrate au cours d’une réaction irréversible catalysée par la citrate synthétase. Cette réaction est la première d’un cycle composé de 10 réactions appelé cycle de Krebs, cycle du citrate, cycle des acides tricarboxyliques ou encore cycle des décarboxylations oxydatives (Figure 6).
Chaque tour de ce cycle produit des coenzymes réduits (NADH,H+ et FADH2), du dioxyde de carbone et de l’oxaloacétate qui peut de nouveau intervenir dans la condensation d’une molécule d’acétyl-CoA.
2.4. Ré-oxydation des coenzymes réduits et synthèse d’ATP
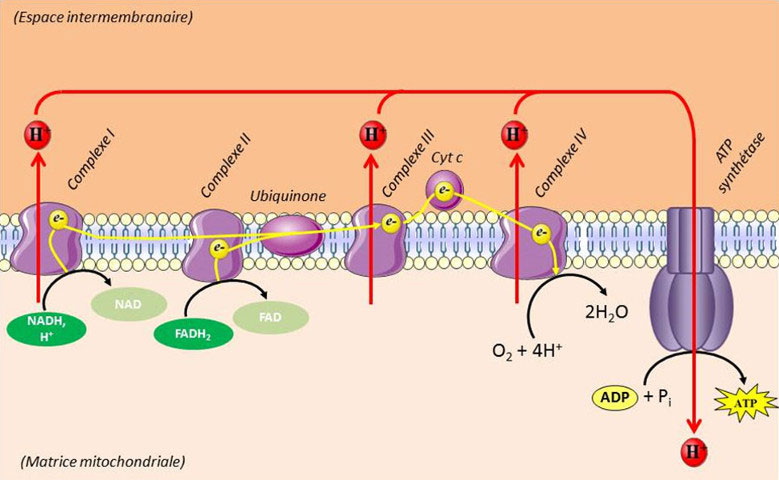
Les différentes réactions d’oxydation que subissent les substrats métaboliques, aussi bien dans le cytosol que dans la matrice mitochondriale, aboutissent à la réduction de nombreuses molécules de coenzymes. La ré-oxydation de ces coenzymes s’effectue principalement au niveau d’un ensemble de complexes enzymatiques localisés au niveau de la membrane interne de la mitochondrie appelé chaîne de transfert des électrons ou chaîne respiratoire (Figure 7).
Les deux premiers complexes de cette chaîne sont des déshydrogénases qui oxydent le NADH,H+ en NAD (complexe I) et le FADH2 en FAD (complexe II) respectivement. Les électrons issus de ces réactions d’oxydation sont ensuite canalisés vers une Coenzyme QH2-Cytochrome c réductase (complexe III) via un système d’ubiquinones (coenzyme Q), puis vers la Cytochrome c oxydase (complexe IV) via une petite hémoprotéine hydrophile localisée dans l’espace intermembranaire, le Cytochrome c. Le complexe IV catalyse la réaction de réduction terminale du métabolisme oxydatif qui apporte quatre électrons à une molécule de dioxygène pour produire deux molécules d’eau (réduction tétravalente de l’oxygène) sans formation de composés intermédiaires.
O2 + 4H+ + 4e– → 2H2O
Le transfert des électrons dans cette chaîne de réactions d’oxydoréduction s’accompagne d’une accumulation de protons dans l’espace intermembranaire à l’origine d’un gradient électrochimique de part et d’autre de la membrane mitochondriale interne. La dissipation de ce gradient par le biais d’un flux de protons dans le canal à protons de l’ATP synthétase (complexe V) permet la catalyse de la réaction de synthèse d’ATP à partir d’ADP et de phosphate inorganique (Pi).
ADP3- + OH-PO32- + H+ → ATP4- + H2O
La variation d’enthalpie libre standard de cette réaction est DG°=+30 KJ /mol. On considère généralement que le passage de trois protons à travers le canal de l’ATP synthétase est nécessaire pour fournir l’énergie de synthèse d’une molécule d’ATP (réaction endergonique).
3. Utilisation cellulaire de l’ATP
Les cellules vivantes doivent donc en permanence prélever de l’énergie dans le milieu ambiant. L’adénosine triphosphate (ATP) est une molécule organique de la cellule, qui fournit l’énergie nécessaire aux réactions chimiques du métabolisme cellulaire, à sa régulation et au transport de l’énergie dans la cellule.
3.1. Besoins cellulaires en énergie
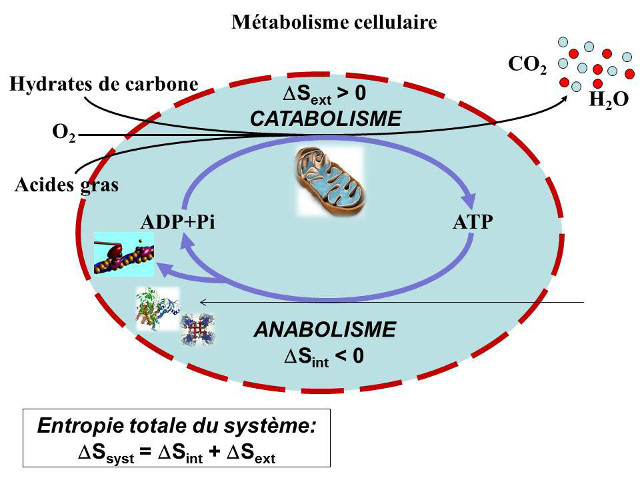
Selon Schrödinger [8], pour assurer leur homéostasie, c’est-à-dire leur processus de régulation interne (synthèse de molécules organiques entretien de gradients ioniques, etc.) et à plus forte raison pour proliférer, les cellules vivantes échangent en permanence des métabolites (petites molécules organiques) avec leur environnement : ce sont des systèmes ouverts. Ces échanges avec l’extérieur leur permettent d’extraire de leur milieu de l’énergie libre (énergie non dissipée sous forme de désordre) pour maintenir leur niveau d’organisation interne. Cette énergie est transférée aux cellules par le biais de réactions anaboliques, qui sont des synthèses moléculaires productrices d’adénosine triphosphate ATP.
Les réactions anaboliques conduisent à une diminution de l’entropie cellulaire interne (DSint) qui s’accompagne nécessairement, selon le second principe de la thermodynamique, d’une augmentation de l’entropie du milieu (DSext). Cette dernière est obtenue par le biais de dégradations moléculaires consommatrices d’ATP appelées réactions cataboliques.
Ces réactions, anaboliques et cataboliques, sont donc directement couplées. Elles forment un système de conversion de l’énergie libre impliquant la synthèse et l’utilisation d’adénosine triphosphate ATP (Figure 8).
3.2. Régulation du métabolisme énergétique
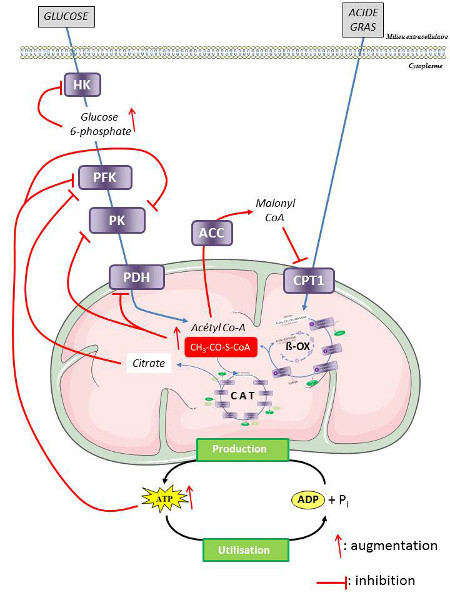
Les besoins cellulaires en énergie sont très variables, particulièrement dans les tissus les plus consommateurs comme le cœur ou les muscles squelettiques. Cependant, parmi toutes les fonctions cellulaires qui nécessitent de l’énergie, la production de travail mécanique reste la plus consommatrice. La machinerie métabolique doit donc être en mesure de s’adapter à tout moment aux modifications d’activité d’un individu.
Étant donné qu’il n’existe pas de réserve d’ATP dans les cellules, c’est la production de l’énergie qui doit être très rapidement modulable pour faire face à ces fluctuations. Ainsi, au cours d’un exercice physique, l’ensemble des réactions du métabolisme énergétique est activé alors qu’elles sont, en situation de repos, très largement inhibées.
Sur un plan biochimique, les principaux acteurs de cette régulation sont les composés énergétiques eux-mêmes. L’ATP, comme l’ensemble des composés à haut potentiel énergétique pour la cellule (comme la phosphocréatine ou le citrate), exercent globalement un effet inhibiteur sur le métabolisme, alors que les produits de dégradation de l’ATP (ADP, AMP, Pi) ont un effet activateur (Figure 9).
3.3. Transport de l’énergie dans la cellule
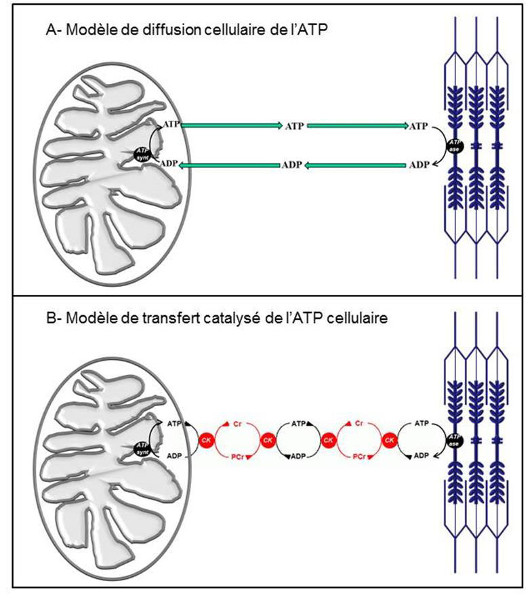
Les sites de consommation d’ATP dans les cellules sont distribués de façon très variable entre les différents compartiments cellulaires. À titre d’exemples, les pompes ioniques, qui interviennent dans le maintien de l’homéostasie cellulaire ou dans l’activité électrique des cellules excitables (cellules musculaires, neurones, etc.), sont localisées dans les systèmes membranaires (membrane plasmique, réticulum endoplasmique), alors que les ATPases, responsables de l’activité mécanique des protéines contractiles, sont très largement distribuées dans le cytoplasme des cellules musculaires. Les distances physiques qui séparent les sites de production de l’ATP dans les cellules et les sites d’utilisation de l’énergie sont donc très hétérogènes et les besoins de transfert rapide d’énergie au sein des cellules sont totalement incompatibles avec un phénomène lent de simple diffusion dans le cytoplasme (Figure 10A).
Une réaction enzymatique réversible catalysée par la créatine kinase (CK) permet une accélération considérable du transfert de l’ATP dans le cytosol.
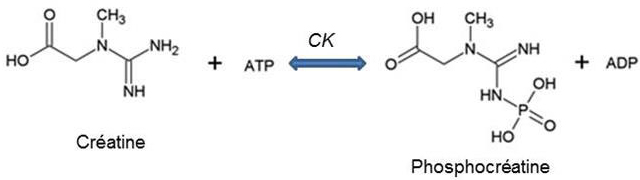
Une chaîne de réactions rapides d’échange du groupement phosphate entre l’ADP et la créatine s’établit entre le site de production de l’ATP et les sites d’utilisation permettant un transfert quasi instantané de l’énergie cellulaire (Figure 10B).
3.4. Conversion de l’énergie des liaisons anhydres phosphoriques de l’ATP en énergie mécanique dans la cellule musculaire
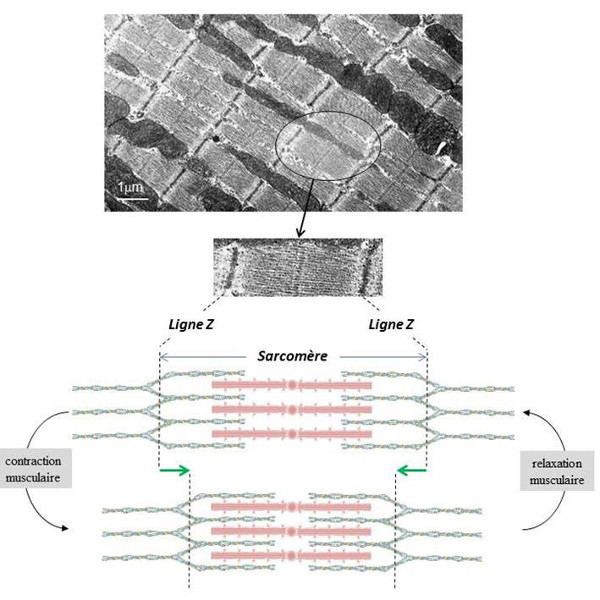
L’ATP produit par les cellules de l’organisme est nécessaire à l’ensemble des activités regroupées sous le terme d’anabolisme. La contraction des cellules musculaires, qui utilise l’énergie chimique de l’ATP pour produire de l’énergie mécanique, est fortement consommatrice d’énergie. Chez les mammifères, il existe différents types de muscles qui se distinguent par leur structure, leurs modes d’activation et de régulation et leur activité mécanique. Parmi eux, les muscles squelettiques sont les plus consommateurs d’énergie car ils sont impliqués dans la mobilisation du squelette lors du mouvement et du déplacement dans l’environnement. Comme le muscle cardiaque, les muscles squelettiques font partie des muscles striés du fait de leur apparence quasi-cristalline à l’observation microscopique (Figure 11). Leur activité est sous contrôle volontaire du fait de leur innervation par le système nerveux somatique.
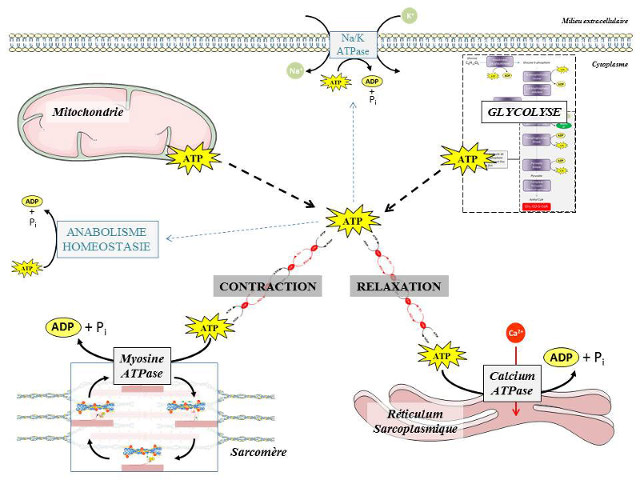
La concentration en ATP dans les cellules musculaires est faible (de l’ordre de 1 à 5 mM). C’est grâce à la réactivité des systèmes de régulation du métabolisme énergétique que la consommation d’ATP par le muscle peut atteindre des valeurs très élevées (jusqu’à 1 M/min). Lors du passage de l’état de repos à l’état d’exercice les besoin en ATP du muscle squelettique sont multipliés par un facteur 100 à 1000. L’ATP produit par la cellule est alors majoritairement canalisée vers les acteurs du cycle contraction-relaxation (Figure 12) afin de permettre la production d’énergie mécanique.
À titre d’illustration (Figure 13), la pompe sodium/potassium (NaK/ATPase) de la membrane plasmique, qui est l’un des principaux acteurs du maintien de l’homéostasie ionique cellulaire, consomme environ 40% de l’ATP produit en conditions de repos dans une cellule musculaire [9], alors que son activité ne représente plus que 1,5 à 7% de la dépense énergétique pendant la contraction musculaire [10].
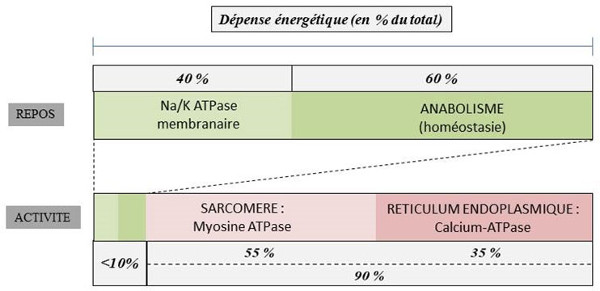
Au repos, l’ATP produit par la cellule musculaire à partir de l’oxydation des substrats organiques est utilisé pour le maintien de l’homéostasie cellulaire et pour les réactions anaboliques. Dans la phase active de la contraction, la consommation globale d’ATP par la cellule musculaire est multipliée par 10. L’hydrolyse de l’ATP par les ATPases sarcomériques (55%) et réticulaires (35%) représente alors 90% de la consommation totale d’énergie [11].
3.5. Utilisation de l’énergie dans la cellule musculaire striée
Le cycle contraction/relaxation des cellules musculaires striées consomme de l’ATP principalement à deux niveaux : 1) au niveau des ATPases des sarcomères pour permettre le glissement des filaments d’actine et de myosine ; 2) au niveau des ATPases de la membrane du réticulum sarcoplasmique pour permettre le repompage du calcium cytoplasmique nécessaire à la relaxation.
3.5.1. Activité ATPasique de la myosine
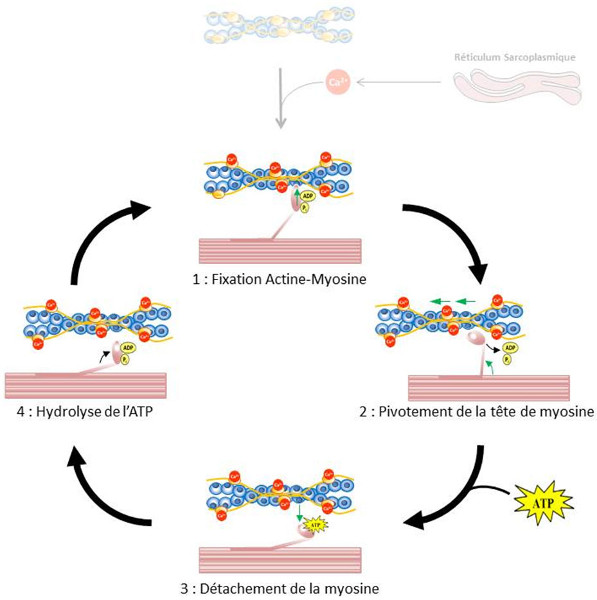
La contraction de la cellule musculaire squelettique résulte du glissement des filaments d’actine et de myosine au niveau des unités contractiles (sarcomères). La myosine présente une activité de type ATPase [12] impliquée dans son interaction cyclique avec l’actine permettant le coulissement des filaments fins et épais dans le sarcomère. L’hydrolyse de l’ATP par la myosine est une réaction lente qui est accélérée par la présence d’actine (notamment quand la fixation du calcium sur la tropomyosine a libéré les sites d’interaction entre l’actine et la myosine).
La réaction d’hydrolyse de l’ATP ne coïncide pas avec l’étape de génération de la force. En effet, la fixation de l’ATP sur la tête de myosine induit une diminution de l’affinité de la myosine pour l’actine, ce qui conduit à une séparation du complexe actine-myosine et à une hydrolyse rapide de l’ATP. La myosine forme alors un complexe stable avec l’ADP et le phosphate inorganique (Pi) produits par la réaction. La myosine se trouve alors dans une structure dite à « haute énergie ». En absence d’actine la libération de l’ADP et du Pi est lente.
En revanche ce complexe présente une haute affinité pour l’actine à laquelle elle va se fixer. Ainsi, l’interaction actine-myosine nécessaire à la contraction musculaire est fortement régulée par l’hydrolyse de l’ATP (Figure 14). Le développement de la force mécanique (ou le mouvement) résultant de cette interaction cyclique entre l’actine et la myosine a lieu par un mécanisme de bras de levier résultant du changement de conformation de la myosine.
L’interaction entre l’actine et la myosine est rendue possible par l’augmentation de la concentration en calcium intracellulaire dans la cellule musculaire qui, en se fixant sur la troponine, va libérer les sites d’interaction entre l’actine et la myosine.
1: Le complexe myosine-ADP-Pi se fixe sur les filaments d’actine.
2: La libération de l’ADP et du Pi est associée à un pivotement de la tête de myosine qui entraîne avec elle le filament fin auquel elle est liée (système de bras de levier).
3: L’arrivée d’une molécule d’ATP qui se fixe sur la myosine diminue fortement l’affinité de la myosine pour l’actine et le complexe actine-myosine se dissocie.
4: l’hydrolyse de l’ATP en ADP et Pi par l’activité ATPase de la myosine induit un changement de conformation de la myosine qui forme alors un complexe avec l’ADP et le Pi qui présente une forte affinité pour l’actine.
3.5.2. Calcium-ATPase du réticulum sarcoplasmique
Le cycle d’interaction actine-myosine décrit précédemment a lieu en continu d’une part tant que de l’ATP est fourni au système et d’autre part tant que les sites de fixation pour la myosine sur l’actine sont accessibles, c’est-à-dire tant que la concentration cytosolique en calcium est élevée. À l’état de repos, la concentration en calcium dans le cytosol des cellules musculaires est faible (inférieure à 0.1 microM). La majorité du calcium intracellulaire est alors séquestrée dans le réticulum sarcoplasmique.
Lorsque la cellule musculaire est stimulée par le système nerveux, le réticulum sarcoplasmique libère ce calcium et la concentration cytoplasmique atteint jusqu’à 10 microM, permettant la contraction de la cellule. La relaxation de la cellule ne sera possible que lorsque la concentration en calcium dans le cytoplasme aura retrouvé sa valeur de repos. Le retour du calcium dans les citernes du réticulum sarcoplasmique n’est possible que par un transfert actif car le gradient de concentration entre le compartiment réticulaire et le compartiment cytosolique n’est jamais favorable à un mouvement entrant du calcium. Ce mécanisme de transport actif est assuré par une enzyme de la famille des ATPases de type P, la Calcium-ATPase du Réticulum Sarcoplasmique (SERCA, Sarco-Endoplasmic Reticulum Calcium ATPase). Cette enzyme transmembranaire, qui est la protéine la plus abondante de la membrane du réticulum (70 à 80%), utilise l’énergie de l’hydrolyse de l’ATP pour transporter le calcium vers l’intérieur du réticulum sarcoplasmique.
Ainsi, bien que la consommation d’énergie par la calcium-ATPase du réticulum ne conduit pas à la production de mouvement à proprement dit, elle permet le relâchement des cellules musculaires et intervient donc directement dans le cycle contraction-relaxation nécessaire au mouvement.
4. Conclusion
Les organismes hétérotrophes, incapables d’élaborer leur propre matière organique, doivent recourir à des constituants organiques préexistants provenant d’autres organismes, végétaux ou animaux, vivants ou morts. Pour couvrir leurs besoins en énergie, ils utilisent les constituants organiques de la biomasse en les oxydant au cours du processus de respiration mitochondriale, transformant l’énergie libérée sous forme d’ATP au cours de ces réactions d’oxydo-réduction, en énergie mécanique, électrique, ou calorifique. Cette énergie cellulaire est indispensable à de nombreux processus tels que la croissance et le développement des tissus, les transports transmembranaires, notamment les pompes ioniques membranaires, ou le raccourcissement des sarcomères lors de la contraction des cellules musculaires.
L’interdépendance des systèmes décrits dans cet article autorise une régulation fine et une adaptation rapide et efficace de la production cellulaire d’énergie en fonction des besoins instantanés des cellules. Au niveau des cellules musculaires, ce système de conversion de l’énergie permet de pallier l’absence de réserves tissulaires d’énergie utilisable par la cellule et d’assurer une production continue d’ATP, modulable en fonction des besoins, assurant ainsi une contraction musculaire en permanence efficace.
Notes et références
[1] Note de l’éditeur : qui se nourrissent uniquement d’aliments non organiques, c’est-à-dire n’ayant pas une origine biologique. En présence de lumière, les végétaux (et certaines bactéries) produisent des molécules organiques à partir de molécules minérales simples (gaz carbonique CO2, eau H2O,…) par photosynthèse.
[2] Note de l’éditeur : concerne les bactéries qui se développent aussi de façon autotrophe, à partir de molécules minérales, mais en l’absence de lumière (dans le sol, les fonds marins…). Ces bactéries se nourrissent par des réactions chimiques entre le gaz carbonique et différents éléments chimiques (soufre, fer,…) ; le procédé est appelé chimiosynthèse.
[3] Note de l’éditeur : qui utilise pour se nourrir les matières organiques issues d’autres organismes vivants.
[4] Bernard C. (1878-1879). Leçons sur les phénomènes de la vie communs aux animaux et aux végétaux. Paris: Baillière, 2 vols. 404 p. et 564 p
[5] Mashek D.G., Coleman R.A. (2006). Cellular fatty acid uptake: the contribution of metabolism. Curr Opin Lipidol, n°17, pp. 274-278
[6] Schaffer J.E. (2002). Fatty acid transport: The roads taken. Am J Physiol Endocrinol Metab, n° 282, pp. 239-246
[7] Knudsen J. (1990). Acyl-CoA-Binding Protein (ACBP) and its relation to Fatty Acid Binding Protein (FABP): An overview. Mol. Cell. Biochem, n°98, pp. 217-223
Knudsen J., Neergaard T.B.F., Gaigg B., Jensen M.V, Hansen J.K.. (2000). Role of acyl-CoA binding protein in acyl-CoA metabolism and acyl-CoA-mediated cell signaling. J. Nutr, n°130, pp. 294-298.
[8] Schrödinger E. (1944). What is life? Cambridge: University Press.
[9] Swaminathan R., Chan E.L.P., Sin L.Y., King N.S, Fun N. S., Chan A.Y.S. (1989). The effect of ouabain on metabolic rate in guinea pigs: estimation ofenergy cost of sodium pump activity. Br. J. Nutr, n°61, pp. 467-473
[10] Barclay C.J., Woledge R.C., Curtin N.A. (2007). Energy turnover for Ca2+ cycling in skeletal muscle. J. Muscle Res. Cell. Motil, n° 28, pp. 259-274
[11] Barclay C.J., Lichtwark G.A., Curtin N.A. (2008). The energetic cost of activation in mouse fast-twitch muscle is the same whether measured using reduced filament overlap or N-benzyl-p-toluenesulphonamide. Acta. Physiol, n°193, pp. 381-391
[12] Engelhardt W.A., Ljubimowa N.M. (1939). Myosine and adenosinetriphosphate. Nature, n°144, pp. 668-669
L’Encyclopédie de l’Energie est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article, merci de mentionner le nom de l’auteur, le titre de l’article et son URL sur le site de l’Encyclopédie de l’Energie.
Les articles de l’Encyclopédie de l’Energie sont mis à disposition selon les termes de la licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Pas de Modification 4.0 International.







