En réponse aux besoins illimités de stockage de l’électricité, les accumulateurs occupent une place centrale. D’où les enjeux technologiques, écologiques, économiques et politiques de leur développement. Ils s’apprécient par une connaissance approfondie des principes de l’accumulation, de la diversité des appareils, de leurs capacités de stockage et de leur cycle de vie.
La production et le stockage de l’énergie deviennent un enjeu majeur au fur et à mesure de l’évolution des technologies. Cela est dû à l’accroissement global de la consommation en énergie électrique et à celui du nombre d’appareils électroniques nomades devant être alimentés. Il est alors nécessaire d’augmenter les capacités de stockage d’énergie électrique et le rendement de celles-ci. Pour aborder ses thématiques, il faut tout d’abord reprendre les bases d’électrochimie sur lesquelles s’appuient les accumulateurs, puis en présenter plusieurs types ayant différentes propriétés. Nous détaillerons les multiples usages de ces accumulateurs avant d’étudier les enjeux liés à ceux-ci.
1. Éléments théoriques essentiels sur les piles et accumulateurs
Il apparait très tôt le besoin de stocker de l’énergie. La prédominance et la facilité d’utilisation de l’énergie électrique orientent la recherche vers son stockage entre le 18ème et le 19ème siècle. Un moyen développé pour résoudre ce problème est de tirer parti des propriétés électrochimiques de matériaux afin d’inventer des dispositifs capables de retenir des charges électriques. Les piles et les accumulateurs étaient alors créés.
1.1. Les piles
Les piles représentent des générateurs d’énergie simples, peu chers, facilement transportables et de faible volume. Elles permettent de délivrer de l’énergie électrique par réaction d’oxydoréduction. Elles ne sont pas rechargeables et donc non réutilisables après une première décharge complète. Cela les place dans la catégorie des générateurs électrochimiques primaires. Elles ont généralement une forte capacité et une forte densité d’énergie, cependant, la limite d’une unique décharge des piles peut être une contrainte.
1.2. Les accumulateurs
Les accumulateurs se distinguent des piles par leurs capacités à être rechargés. En effet, ces systèmes sont dits renversables et peuvent fonctionner en générateur lors d’une décharge et en récepteur lors d’une charge. Cette propriété classe les accumulateurs en tant que générateurs électrochimiques secondaires. Les accumulateurs ont généralement une plus faible densité d’énergie et des pertes au court du temps plus importantes que les piles, mais elles peuvent être restaurées par recharge. Ceux-ci sont la plupart du temps associés entre eux en série ou parallèles afin de créer des batteries de capacité plus élevée et de tension nominale adaptée.
Il existe d’autres techniques de stockage de l’énergie comme les super condensateurs ou les piles à combustible (Lire : Les piles à combustible).
1.3. Fonctionnement des piles et accumulateurs
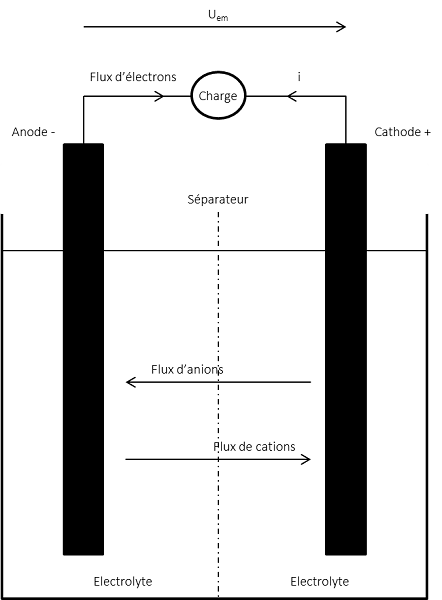
Le fonctionnement des piles et des accumulateurs repose sur les réactions d’oxydoréduction, mettant en jeu deux couples formés chacun d’un oxydant et d’un réducteur, noté (Ox/Red), pouvant s’échanger un ou plusieurs électrons. Un couple d’oxydant-réducteur forme une demi-cellule électrochimique dont on peut donner la demi-équation d’échange électronique. La connexion entre elles de deux demi-cellules forme une cellule complète que l’on appelle pile. Une pile sera constituée d’une anode, pôle négatif, siège d’une oxydation des réactifs et d’une cathode pôle positif où a lieu la réduction.
Prenons l’exemple d’une pile alcaline, la plus couramment utilisée pour des applications portables de nos jours, car possédant une capacité importante à un prix raisonnable et fonctionnant bien à température ambiante. Elle est composée d’une anode en zinc et d’une cathode en dioxyde de manganèse, plongées dans un électrolyte aqueux de potasse (KOH). Les deux couples (Ox/Red) mis en jeu sont : $$MnO_2/ Mn(OH)_2$ et$ Zn(OH)_2/Zn$$ de demi-équation :
$$ 2MnO_2 + 2H_2O + 2e^- rightarrow 2MnO(OH) + 2OH^-$$
$$Zn(OH)_2 + 2e^- rightarrow Zn + 2OH^-$$
L’équation totale de réaction est :
$$2MnO_2 + 2H_2O + Zn rightarrow 2MnO(OH) + Zn(OH)_2.$$
Il y a réduction du zinc et oxydation du manganèse avec l’échange d’un électron par mole de réactif. Les électrodes (anodes et cathodes) sont plongées dans un électrolyte permettant la migration des anions de la cathode à l’anode et des cations dans le sens opposé. Un matériau séparateur isole les deux électrodes, mais laisse passer les ions. Ce processus est schématisé dans la Figure 2.
Cette réaction fait apparaitre une force électromotrice dans la cellule $$U_{em}$$, qui, à vide (sans intensité i délivrée), dans le cadre d’un équilibre électrochimique est égale à la différence des potentiels standards de réaction des couples en présence : $$U_{em} = left(E^0_1 – E^0_2right)$$, de l’ordre du volt. Dans notre exemple $$E^0_1(MnO2/MnOOH) = 0,3V$$, $$E^0_2(Zn(OH)2/Zn) = -1,25V$$ nous obtenons une force électromotrice induite de 0,3 – (-1,25) = 1,55 V. Ce n’est cependant que la tension théorique pouvant être délivrée. Elle dépend en réalité de la température et des activités des constituants, suivant la formule de Nernst :
$$E_1 = E^0_1 + left(dfrac{RT}{nF}right)lnleft(dfrac{a_{ox}}{a_{red}}right)$$
Avec, R constante des gaz parfaits, T la température, n le nombre d’électrons échangés, F constante de Faraday, $a_{ox}$ et $a_{red}$ respectivement les activités de l’oxydant et du réducteur. La tension nominale typiquement retenue pour les piles alcalines sera de 1,5 V plus faible que la tension théorique à cause de la cinétique limitée de la réaction.
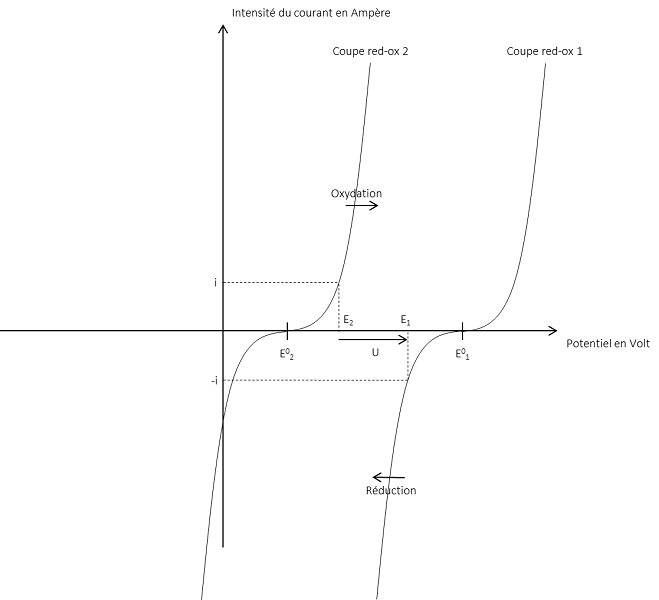
Il est aussi intéressant de tracer la courbe intensité-potentiel de la pile, en Figure 3 ci-dessous. Elle représente l’intensité traversant la pile en fonction de la tension. On observe sur la figure les deux réactions d’oxydoréduction se produisant, la tension U, le courant i, les potentiels de Nernst et les potentiels standards.
Ainsi, lors d’une décharge, vu la relation de Nernst, le potentiel E_1 diminue alors que le potentiel E_2 augmente. Cela implique que la force électromotrice (la tension délivrée par la pile ou l’accumulateur) décroit au cours de son fonctionnement.
1.4. Cas particulier des accumulateurs
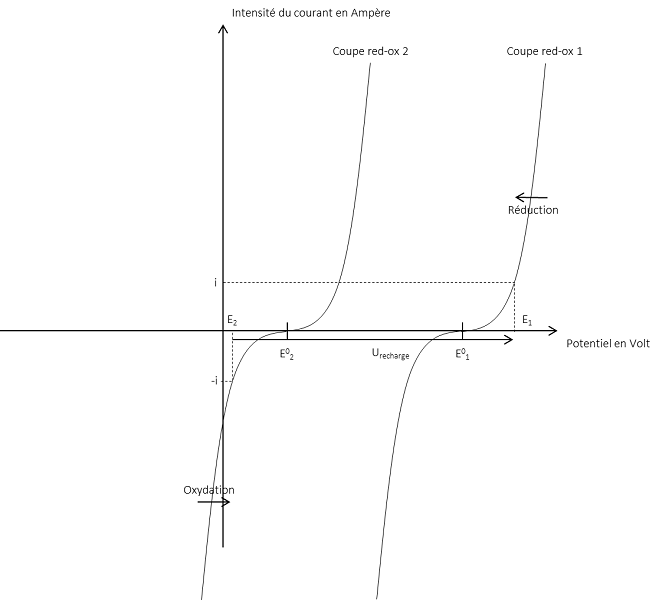
Les données précédentes concernant la décharge d’une pile restent valables pour les accumulateurs. Cependant, en plus d’être des générateurs d‘énergie, les accumulateurs peuvent aussi fonctionner comme récepteur d’énergie lors de la recharge. Cette capacité dépend fortement des couples d’oxydants-réducteurs mis en jeu. Elle permet de reformer les réactifs lorsqu’une tension supérieure à la force électromotrice théorique de la cellule est appliquée en inverse à ses bornes. C’est une électrolyse. Cette réaction peut également être décrite par une courbe intensité-potentielle comme en Figure 4. Apparaissent alors la tension de recharge $$U_{recharge}$$, les deux nouvelles réactions d’oxydation et de réduction mises en place, l’intensité i, les potentiels de Nernst et les potentiels standards.
La charge d’un accumulateur impose certaines contraintes : afin de reformer les réactifs, il est nécessaire que les produits de la décharge et de la recharge restent au voisinage des électrodes. Il faut limiter le courant de charge pour contenir l’augmentation de la température. De plus, il existe des risques dus au solvant utilisé comme électrolyte dans la réaction, un courant ou une tension trop importante peut entrainer son oxydation ou sa réduction. Cela se traduira par l’impossibilité de recharger l’accumulateur et un dégagement gazeux pouvant conduire à une explosion (c’est le risque aussi encouru lors de la recharge d’un générateur électrochimique primaire n’étant pas censé être rechargé). Par exemple la réduction de $$H_2O$$ solvant couramment utilisé en $$O_2$$ ou son oxydation en $$H_2$$.
2. Types et propriétés des accumulateurs
Maintenant que le principe de fonctionnement des accumulateurs a été rappelé, il faut désormais aborder les différents types d’accumulateurs existants et les moyens de les caractériser. La durée de vie de ces accumulateurs est aussi un point essentiel à prendre en compte.
2.1. Types d’accumulateurs
L’un des premiers accumulateurs dont le concept a été pensé dès 1860 par Gaston Planté est la batterie au plomb. Elle se compose d’une anode en plomb (Pb), d’une cathode en oxyde de plomb (PbO2) plongée dans de l’acide sulfurique (H2SO4) qui constitue l’électrolyte. Elles sont majoritairement utilisées dans l’automobile et ont des capacités comprises entre 1 et 1200 Ah. La réaction totale est :
$$Pb + PbO2 + 2 H2SO4 longleftrightarrow 2PbO2 + 2H20$$
La réaction se déroule dans le sens direct lors de la décharge et indirect lors de la charge.
Un autre type d’accumulateur utilisé dans tous les secteurs industriels, mais aussi militaires, ferroviaire et spatial est l’accumulateur au Nickel Cadmium. Il est composé d’une anode en cadmium (Cd), d’une cathode en oxyde de nickel (NiOOH) dans un solvant de potasse (KOH). Ce type de batterie est utilisé pour les mêmes applications que les batteries au plomb, mais celui-ci est plus fiable et robuste. Il existe des batteries Ni-Zn, Zn-AgO, Cd, AgO, Ni-MetalHydrure (NiMH), utilisant un solvant de potasse.
Enfin, les batteries lithium-ion inventées en 1980 se sont désormais imposées comme référence des accumulateurs. Elles sont utilisées pour les applications électroniques grand public, militaires, et les véhicules électriques. Les électrodes couramment utilisées sont une cathode de LiCoO2 (oxyde de lithium-cobalt) et une anode de carbone graphite. L’électrolyte utilisé est le LiPF6. Le courant électrique est créé par un échange d’ions Li+ entre l’anode et la cathode entrainant la libération d’un électron. La réaction totale peut s’écrire :
$$LiCoO2 + C + xLi+ + xe- longleftrightarrow LixC + Li1-xCoO2 + xLi+ + xe-.$$
Dans le sens direct lors de la charge et indirect lors de la décharge. Les batteries peuvent être conçues sous forme cylindrique ou prismatique, cette dernière améliorant la densité de puissance. Il faut distinguer les accumulateurs Li-ions des piles au lithium, qui sont des générateurs électrochimiques primaires.
2.2. Capacité et énergie spécifique
Il est alors important de définir la capacité d’un accumulateur. Elle s’exprime en Coulomb (C) et correspond à la quantité de charges (électrons) pouvant être délivrées par l’accumulateur. Un constituant échangeant un électron lors de la réaction pourra délivrer une charge égale à la constante de Faraday F, $$F=N_ae=96487 C/mol$$ avec $$N_a$$ le nombre d’Avogadro et e la charge élémentaire. Ainsi, on détermine la capacité Q d’un accumulateur en multipliant la constante de Faraday par le nombre d’électrons échangés et par le nombre de moles de constituants. Cependant, l’unité couramment utilisée pour définir la charge est l’ampère-heure (Ah), car elle est plus parlante. 1 C est égal à 1 As (courant de un ampère délivré pendant une seconde), donc 1 Ah correspond à 3600 C. Afin de rendre la capacité indépendante de la masse des réactifs, on utilise principalement la capacité massique c d’un accumulateur exprimé en Ah/kg,
$$c=ndfrac{F}{M}$$
Avec n le nombre d’électrons mis en jeu dans la réaction, F la constante de Faraday et M la masse molaire des constituants. Ainsi, un accumulateur de 1 kg de capacité massique 5 Ah/kg pourra délivrer un courant de 5 Ampères pendant une heure.
Ayant défini la capacité massique d’un accumulateur, il est enfin intéressant de considérer l’énergie que peut contenir l’accumulateur. Ce sera son énergie spécifique. Les lois de la thermodynamique impliquent que le travail électrique récupérable, donc l’énergie contenue dans la pile, sera toujours majoré par l’enthalpie libre ΔG,
$$Delta G = -nFleft( E^0_1- E^0_2right)$$
Avec n le nombre d’électrons intervenant dans la réaction, F la constante de Faraday et $$left( E^0_1- E^0_2right)$$ la différence de potentiel standard de réaction des couples red/ox mis en jeu. Il faut donc garder à l’esprit que l’énergie que nous pouvons calculer avec ces formules est maximale et théorique, non atteinte.
En pratique, pour déterminer l’énergie contenue dans un accumulateur, on multiplie la capacité massique par la tension théorique pouvant être délivrée, on obtient alors l’énergie spécifique de l’accumulateur exprimée en Wattheure (qui est l’unité d’une énergie) par kilogramme (Wh/kg). Dans le cas d’une pile alcaline, la tension théorique fournie est de 1,55 V, sa capacité massique de 224 Ah/kg, ainsi son énergie spécifique est de 347 Wh/kg. C’est cette dernière donnée propre à chaque accumulateur qui est utilisée afin de les comparer et de les caractériser. Ces calculs de capacité, d’énergie spécifique sont définis pour un usage à 25 °C (298 K). La température est importante puisque nous avons vu qu’elle joue un rôle déterminant dans les réactions d’oxydoréduction. Elle devra être considérée comme étant un paramètre prépondérant au bon fonctionnement des accumulateurs. Une température d’utilisation d’une batterie Li-ions supérieure à 70 °C endommage irrémédiablement l’accumulateur. Il est souvent précisé la température de fonctionnement des accumulateurs dans les appareils les contenant, 40 °C pour un ordinateur par exemple. Les différentes caractéristiques de piles et accumulateurs courants sont répertoriées dans le Tableau 1.
Tableau 1 : Capacités massiques, énergie spécifique théorique et pratique de piles et accumulateurs
| Piles alcalines | Piles lithium | Accumulateur au plomb | Accumulateur Ni-Cd | Accumulateur Ni-MH | Accumulateur lithium-ion | |
| Capacité massique théorique (Ah/kg) | 224 | 230 | 120 | 181 | 178 | 100 |
| Énergie spécifique théorique (Wh/kg) | 347 | 1001 | 252 | 244 | 240 | 410 |
| Énergie spécifique pratique (Wh/kg) | 145 | 230 | 30-50 | 45-80 | 60-110 | 150-190 |
On observe une différence entre les énergies spécifiques théoriques et pratiques dues entre autres à la présence dans les accumulateurs de composés n’intervenant pas dans la réaction, mais influant sur sa masse (conteneur, séparateur), d’une décharge non totale (elle n’est en réalité que de 50 à 75 %), d’une tension nominale inférieure à la tension théorique et à une présence non stœchiométrique des réactifs.
On parle parfois de densité d’énergie contenue dans le volume (en Litre) de la batterie en Wh/L.
Il faudra ainsi comparer l’énergie spécifique des accumulateurs et essayer de l’accroitre afin que les futures batteries puissent contenir et transporter plus d’énergie dans une masse plus faible.
2.3. Cycles de vie des accumulateurs
Afin d’utiliser des batteries dans les milieux industriels, militaires, ou tout simplement dans des appareils technologiques, il est important de déterminer sa durée de vie ou tout du moins la période temporelle pendant laquelle son fonctionnement sera optimal. Celle-ci va dépendre en grande partie du nombre de cycle de charge et de décharge effectué, de la profondeur des décharges et du contrôle ou non de la recharge. Les principales données concernant la durée de vie et la performance d’accumulateurs usuels sont répertoriées dans le Tableau 2 :
Tableau 2 : Facteurs influençant la durée de vie des accumulateurs.
| Accumulateur au plomb | Accumulateur Ni-Cd | Accumulateur Ni-MH | Accumulateur lithium-ion | |
| Nombre de cycle de charge et de décharge maximal | 500-1200 | 2000 | 1500 | 1200 |
| Autodécharge par mois à température ambiante | 5 % | >20% | >30% | 2 % |
| Durée de vie moyenne (en année) | 3-6 | 8-25 | 2-5 | 5+ |
| Effet mémoire | Oui | Oui | Oui | non |
Les problèmes souvent rencontrés sont liés à une décharge trop importante ou à la surcharge lors d’une recharge, correspondant à un apport de charges plus important que ce qui a été retiré de l’accumulateur. La durée de vie des batteries au plomb est diminuée par ces deux facteurs et par le nombre de cycles charge et décharge. Cela accentue et accélère la corrosion des constituants de la batterie, des électrodes et des connexions.
L’effet mémoire correspond à une baisse de capacité de l’accumulateur après des cycles incomplets de charge et décharge.
La profondeur de décharge est diminuée après un certain nombre de charges-décharges. L’accumulateur ne peut plus être déchargé à 100 % de sa capacité initiale après avoir été rechargé, on parle de perte en profondeur de décharge. La durée de vie des batteries lithium-ion est notamment diminuée par la profondeur de décharge qui ne doit pas descendre sous 2 V. Dans le même temps, une surcharge de plus de 200 % peut entrainer l’explosion de la batterie, c’est pourquoi la charge est régulée par des composants électroniques externes. La durée de vie des accumulateurs Li-ions reste cependant supérieure à celle des autres types d’accumulateurs.
Enfin, l’autodécharge est un processus spontané de perte de charge de la batterie, exprimée en pourcentage de la charge totale perdue sur une unité de temps. Cette perte est linéaire en fonction de la température. Celle-ci est plus importante pour des températures élevées. Par exemple, les accumulateurs Li-ions perdent 5 % de leur charge par an à 0 °C contre 80 % à 40 °C. Pour les batteries au plomb, cette perte est de 20 % à 0 °C, mais de 200 % à 40 °C. La rétention, capacité d’un accumulateur à conserver sa charge, est plus importante pour les accumulateurs Li-ions. Elle s’approche de celle des piles au lithium. Nous l’avons vu, les générateurs électrochimiques primaires ont une meilleure capacité de rétention que les accumulateurs.
3. Utilisation des accumulateurs
Les accumulateurs possèdent plusieurs caractéristiques propres permettant de les distinguer et d’évaluer leurs performances. Voyons ci-après deux d’entre eux : l’accumulateur au plomb et l’accumulateur lithium-ions ainsi que leurs domaines d’utilisation.
3.1. Accumulateur au plomb
Les accumulateurs au plomb sont utilisés depuis beaucoup plus longtemps que les accumulateurs Li-ions. Ils sont cependant moins performants. Ils possèdent une énergie spécifique et une densité d’énergie très faible qui expliquent la différence importante de dimension et de masse entre ceux-ci et les accumulateurs lithium-ions. À énergie stockée égale, une batterie au plomb sera nécessairement plus encombrante et plus lourde. De plus, son cycle de vie est faible.
Elles constituent toutefois une part notable du marché dans le monde et restent largement produites. Elle représentait 45 % des ventes de batteries pour l’année 2000. Cela est dû à leurs faibles coûts de production et leurs faibles complexités permettant d’obtenir une gamme d’accumulateurs de capacité allant de 1 Ah à plusieurs milliers. À cela s’ajoutent une grande plage de température de fonctionnement optimal et une grande robustesse.
On retrouve ces batteries dans les applications portables même si elles sont désormais supplantées par celles au lithium, car il est difficile de concevoir des batteries au plomb de forte énergie spécifique. Cependant, leurs domaines traditionnels d’utilisation sont ce qu’on appelle en anglais la SLI (Start, Lightning, Ignition) pour le démarrage et le fonctionnement de tous les appareils électriques d’un véhicule avec des batteries de tension nominale 12 ou 24 V. Elles sont aussi présentes dans certaines voitures comme source d’énergie pour le déplacement, pour des locomotives électriques ou des engins industriels. Cela reste cependant des applications spécifiques et l’utilisation de batteries au plomb pour faire fonctionner des véhicules particuliers reste anecdotique. Ces accumulateurs sont utilisés comme régulateur de puissance ou comme stockage dans des navires.
Un inconvénient majeur des accumulateurs aux plombs reste les risques d’explosions dus au dégagement d’oxygène et d’hydrogène lors de la recharge. Ainsi l’institut national de recherche et sécurité définit un protocole à suivre afin de recharger les batteries au plomb et les mesures de sécurité à leur appliquer.
3.2. Accumulateur Li-ions
Les accumulateurs lithium-ions se sont imposés sur le marché des batteries pour les biens de consommation électronique, les véhicules hybrides et électriques et le stockage à grande échelle.
Cette prédominance sur le marché de l’électronique de consommation s’explique en partie par une forte énergie spécifique, se rapprochant de celle des générateurs électrochimiques primaires. En effet, chaque cellule Li-ions peut délivrer une tension entre 2,5 et 4,2 V ce qui est très important. Elles ont permis le développement d’appareils portables consommant une quantité importante d’énergie dont la conception n’est rendue viable que par l’apparition d’accumulateurs pouvant supporter cette forte demande dans un espace et une masse très réduits.
Ce plébiscite est aussi accentué par un long cycle de vie, une bonne rétention de charge et une charge rapide, sans effet mémoire et sans nécessiter de maintenance. Elles sont alors utilisées comme batteries de téléphone ou d’ordinateurs. Dans ce type d’applications, leurs capacités sont comprises entre 1 et 10 Ah pour une énergie spécifique entre quelques wattheures et une centaine de wattheures. Pour une batterie lithium-ion de téléphone de 0,05 kg, sa capacité est le produit de sa capacité massique théorique par sa masse, on trouve 2 Ah, et son énergie spécifique, par un calcul similaire, est de 7,5 Wh. Ainsi cette batterie serait capable d’allumer une lampe de 75 W pendant un dixième d’heure. Les appareils électroniques consomment heureusement bien moins d’énergie, autorisant une autonomie plus importante. La mise en série de plusieurs cellules permet d’atteindre les tensions de fonctionnement souhaitées. Ce nombre est indiqué sur la batterie (typiquement plusieurs dizaines), tout comme le type d’électrode utilisée, la forme des cellules et leurs dimensions.
La multiplication incessante d’objets technologiques de consommation alimentés par une batterie implique la progression du nombre d’accumulateurs Li-ions qui continuera d’accroitre sa part de marché. Les batteries lithiums-ions ont cependant le coût de production initial le plus élevé des générateurs électrochimiques secondaires. Bien que celui-ci aille en diminuant, cela peut réduire le marché potentiel de ce type d’accumulateur.
Un second champ d’application concerne les véhicules électriques. Avec l’augmentation des prix du carburant et la diminution des ressources fossiles, ce type de véhicule tend à se développer, car il utilise une énergie électrique pouvant être issue de sources renouvelables et n’émet pas de gaz à effet de serre. Il est de plus actuellement subventionné par l’État. Cela se traduit dans les chiffres avec 17 000 véhicules particuliers électriques vendus en France en 2015, une forte augmentation de 64 % par rapport à l’année précédente. Les voitures électriques sont également et en plus grand nombre utilisé dans le monde professionnel.
Des batteries Li-ions sont équipées sur la plupart des modèles pour des raisons similaires à leur utilisation pour des appareils électroniques de consommation. Cependant, ce développement se heurte à plusieurs limites. La plus importante concerne l’énergie stockée qui est insuffisante. Les batteries actuelles permettent une autonomie comprise entre 100 et 250 km, car l’énergie spécifique de celle-ci est d’environ 150 Wh/kg (Tableau 1). Il est nécessaire d’améliorer ces batteries afin de se rapprocher de l’énergie spécifique théorique de 410 Wh/kg et donc d’une distance parcourue supérieure à 500 km, autant qu’un véhicule thermique. Ceci en réduisant la masse de la batterie. La voiture Zoe de Renault possède une batterie Li-ions d’énergie spécifique 157 Wh/kg et une autonomie de 150 km. Le constructeur TESLA propose un modèle ayant une autonomie annoncée de 500 km. Des améliorations sur la vitesse de recharge et le nombre de bornes de recharge pourraient compenser ce défaut de la batterie.
Un autre frein majeur est le prix de ces véhicules directement lié au coût de la batterie.
Enfin la durée de vie de l’accumulateur étant limité, il faudra le renouveler. Des systèmes de location sont mis en place afin de garantir une batterie en parfait état dans le véhicule à chaque instant. Cela permet de prévenir les risques liés à une batterie endommagée comme l’inflammation en cas de surchauffe. En effet, un courant de charge trop élevé entraine ce danger. La propreté environnementale de ce moyen de transport est tout de même à relativiser, car l’énergie électrique stockée peut avoir été produite par des centrales consommant des ressources fossiles. À cela s’ajoute l’impact de l’extraction des composants nécessaires à la batterie et son traitement en fin de vie.
Enfin, un axe majeur de développement est lié au stockage de l’énergie surproduite. Les accumulateurs Li-ions peuvent être utilisés comme batteries pour le réseau de distribution électrique. Ceux-ci se chargeront lorsque la production d’électricité d’une centrale, d’éoliennes ou de panneaux solaires sera trop importante pour être totalement absorbée par le réseau afin qu’elle ne soit pas perdue. Dans un second temps lorsque la production d’énergie électrique sera insuffisante (typiquement lors des pics de consommation, l’absence de vent pour une éolienne ou l’absence de soleil pour des panneaux photovoltaïques), les accumulateurs seront capables de fournir une grande quantité d’énergie stockée et d’alimenter le réseau pendant un certain temps, sur l’échelle d’une région. Cela répondant au besoin stabilité de la distribution d’électricité, que n’offrent pas l’éolien ou le solaire.
Cette énergie peut être disponible en un temps très court. Ces accumulateurs sont regroupés afin de former des batteries contenant une énergie de l’ordre de la dizaine de Mégawattheure. Les accumulateurs Li-ions sont particulièrement bien adaptés, car ils possèdent un grand nombre de cycles charges et décharges possibles et sans effet mémoire. La durée de vie totale prévisionnelle d’une telle installation est de cinq à quinze ans.
Deux exemples éclairants sont ceux de la centrale de Feldheim en Allemagne et d’EDF Énergie nouvelle. À Feldheim, une énergie de 10 MWh est stockée dans 3360 accumulateurs Li-ions capables de couvrir les besoins du réseau pendant 30 minutes. Chaque accumulateur doit pouvoir stocker environ 3 kWh. Pour une énergie spécifique de l’ordre de grandeur de celle vue précédemment (190Wh/kg), ceux-ci ont nécessairement une masse élevée et occupent un plus grand volume. On ne parle plus d’accumulateurs de taille comparable à celle d’un téléphone, mais de la taille du mètre. D’autre part, EDF Énergie nouvelle a réalisé en 2016 un ensemble de batteries Li-ions pour une énergie de 20 MWh dans l’Illinois aux États-Unis afin de réguler le réseau. Elle considère le stockage d’énergie par batterie comme un secteur d’avenir, ayant déjà près de 130 MWh de projets prévus.
Il est aussi nécessaire de limiter en température les nombreux compartiments de ces immenses batteries. Cela peut requérir une grande quantité d’énergie pour les refroidir, diminuant le rendement global de l’installation.
Enfin, parallèlement aux batteries de stockage d’énergie en masse, se développent des batteries individuelles permettant de stocker l’énergie produite par les panneaux photovoltaïques ou les éoliennes d’un particulier. L’électricité peut ensuite être utilisée pour alimenter les équipements de la maison. C’est une solution récente que l’entreprise américaine Tesla commercialise sous la forme d’une batterie Li-ions de dimensions 1 m sur 1 m sur 20 cm, d’énergie spécifique 6,4 kWh pour un prix de 3000 $.
4. De nombreux enjeux
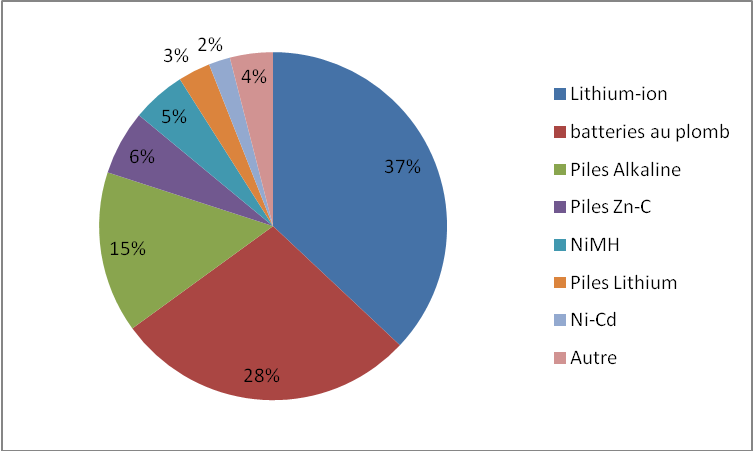
Les accumulateurs sont donc utilisés dans de nombreux domaines et leur production tend à augmenter considérablement. Les acteurs économiques de ce secteur acquièrent du fait de l’impact actuel du stockage de l’énergie une importance majeure. La dominance des batteries Li-ions est désormais peu contestée comme on l’observe sur la Figure 5 représentant la répartition des parts des ventes du marché mondial en 2009. Elles sont présentes dans plus de 1,5 milliard d’appareils et le marché des batteries devrait atteindre 80 milliards de dollars en 2020. Il faut alors détailler les enjeux relatifs à ce type de stockage.
4.1. Des enjeux économiques
Au vu de la Figure 6, le marché des accumulateurs lithium-ion semble le plus important et sujet à un développement rapide, malgré sa présence commerciale plus récente. Il représente 11,7 milliards de dollars en 2012 dans le monde. La fabrication de cet accumulateur reposant majoritairement sur le lithium, l’extraction de ce minéral devient un enjeu important dans l’industrie, au point que l’entreprise d’analyse américaine Goldmans Sachs place le lithium comme un des sept grands thèmes d’avenir.
La production mondiale actuelle est de 31 000 tonnes par an au prix moyen de 5000 dollars par tonne de carbonate de lithium. La consommation globale de lithium est en croissance d’environ 10 % par an et passera à 20 % lors des dix prochaines années. Le marché du lithium est évalué en 2020 à 30 milliards de dollars.
Preuve de l’attractivité économique des batteries Li-ions, le groupe Tesla construit actuellement une usine Gigafactory destinée à la fabrication d’accumulateurs lithium-ions. Elle sera capable de produire dès 2020 des batteries pour un total de 35 GWh ce qui correspond à la production mondiale de batteries Li-ions en 2016. Cette quantité de batteries produites pour cette énergie est censée couvrir les besoins en accumulateur des 500 000 voitures que construira Tesla chaque année et réduira considérablement ses coûts par une économie d’échelle. Le marché des voitures totalement électriques fera progresser et croitre celui des accumulateurs. En 2016, 25 % des accumulateurs lithium-ions sont utilisés dans des véhicules automobiles.
Il faut cependant relativiser l’impact du lithium sur le prix d’un véhicule électrique. Pour Tesla, le coût de l’élément lithium pour une voiture à 75 000 dollars ($) n’est que de 135 $. Le coût d’un kilowattheure d’énergie stocké est néanmoins un élément déterminant. Il regroupe le prix du lithium, mais aussi ceux des processus permettant la création finale d’une batterie. Ce coût s’évalue en dollars par énergie emmagasinée ($/kWh) et est actuellement de 270 à 350 $/kWh. Un coût inférieur à 200 $/kWh est préconisé par les experts afin de rendre abordables les voitures électriques. TESLA annonce un prix de 172 $/kWh, pour ses batteries.
4.2. Des enjeux politiques
Nous venons de voir que le lithium est un élément essentiel dans la fabrication des batteries Li-ions. Mais cette ressource est inégalement répartie dans le monde comme le montre la Figure 6.
On évalue les réserves mondiales à 32,5 millions de tonnes divisées pour 21 MT dans des salars, lacs salés en milieu désertique et pour 11,5 MT dans des filons inclus dans la roche. Les salars se concentrent uniquement dans la zone appelée triangle du lithium formé des déserts argentins, boliviens et chiliens. Ces trois pays disposent de près de 70 % des ressources en lithium de la planète, ce qui les place dans une position dominante.
Ils adoptent alors une posture propre aux régimes politiques de cette région en classant le lithium comme ressource stratégique. La Bolivie, détenant 29 % du total mondial, s’est par exemple approprié les terres rares riches en lithium, car d’après son président Evo Morales, elles sont la propriété du peuple et doivent servir l’industrialisation du pays.
Cela démontre bien la volonté de contrôle de la ressource, mais aussi des investisseurs, comme la société Bolloré, intéressée par le lithium bolivien pour sa voiture électrique blue-car, ou bien le coréen LG, contraint de se soumettre aux transferts de compétences exigés par cet état.
En outre, il est bien plus simple techniquement d’extraire le minerai de lithium des salars que de la roche. Dans les deux cas le lithium n’est pas extrait pur, mais sous forme de carbonate de lithium (LiC03). Il est ensuite nécessaire de le traiter afin d’obtenir le composé utile aux batteries. Cependant, les pays du triangle du lithium ne disposent pas des compétences nécessaires pour réaliser la transformation sur place et doivent se contenter de vendre le minerai simple ce qui représente pour eux un manque à gagner significatif. Cela pousse les gouvernements de ces pays à investir dans la recherche au vu de la croissance attendue dans le secteur des accumulateurs. Le Chili a créé par exemple un institut du lithium et a ouvert l’exploitation des salars à des entreprises privées.
Il semble indiscutable que la possession et le contrôle de cette ressource seront à l’avenir une arme d’influence considérable puisque le lithium devient d’une importance stratégique, même si le risque de pénurie immédiate est faible. En France s’organisent des réflexions afin de trouver des solutions à la dépendance au lithium en cas de conflit dans les zones productrices potentiellement à risque, mais c’est aussi le cas avec tous les métaux rares, comme le cobalt, présent dans ces accumulateurs.
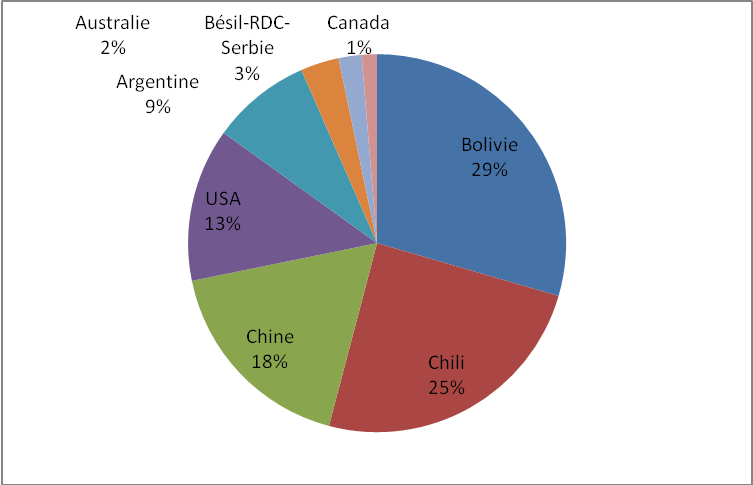 Figure 6 : Répartition de la ressource lithium dans le monde
Figure 6 : Répartition de la ressource lithium dans le monde
4.3. Des enjeux technologiques
Le monde des batteries est en évolution constante afin d’accroitre leur capacité, leur durée de vie, leur sécurité.
La recherche se concentre en particulier sur les batteries Li-ions afin d’atteindre une énergie spécifique de l’ordre de 500 Wh/kg nécessaires à l’industrie des véhicules électriques pour obtenir une autonomie suffisante.
Pour cela, on peut agir sur l’anode de celle-ci. Elle est habituellement en carbone graphite. Son rôle est d’accueillir les cations Li+ pendant le chargement. L’anode peut être remplacée par du Silicium, capable d’accepter plus d’ions Li+ multipliant potentiellement l’énergie spécifique par 10 ce qui est considérable. Cependant, cela entraine une déformation irréversible de l’anode qui ne peut être tolérée, car diminuant trop fortement le nombre de cycles de fonctionnement de la batterie. Il est alors développé des insertions de silicium ou des nano fils de silicium inséré dans l’anode, améliorant les performances de 20 à 40 % tout en influant moins sur le cycle de vie. C’est le gain également attendu par les chercheurs d’EDF travaillant sur cette technologie. Des oxydes de titane sont aussi testés en tant qu’anode, améliorant la vitesse de rechargement.
La cathode est usuellement en oxyde de lithium-cobalt, mais le cobalt est rare et cher. Afin de diminuer les coûts, on peut remplacer ce dernier par du Nickel et du Manganèse. Le lithium peut aussi être couplé avec du phosphate de fer (LiFePO4) augmentant à la durée de vie de l’accumulateur à 2000 cycles, mais réduisant sa densité d’énergie. Cette technologie est développée par l’entreprise grenobloise Prollion en partenariat avec le CEA-Grenoble, EDF et Renault. En ajoutant des dopants et en améliorant la densité du matériau, cette entreprise arrive à des performances d’énergie spécifique proche des valeurs théoriques. Ce type d’anode rend aussi la batterie plus sûre. Prollion a également fabriqué en série un accumulateur d’énergie spécifique 250 Wh/kg unique au monde, à base de silicium. Cela représente 31 % d’augmentation d’énergie spécifique par rapport aux accumulateurs sur le marché. Ils sont utilisés notamment pour envoyer des signaux de détresse en mer pendant plus de 24h. Il est cependant difficile de concilier énergie spécifique et cycles importants de charge et décharge.
Une option pour se passer du lithium peut être le développement de batteries sodium-ions. Elles sont considérées comme une alternative crédible par le CNRS qui mène de nombreuses recherches. L’avantage du sodium est que la migration des cations Na+ ne fait pas subir de déformations aux matériaux composant l’accumulateur, ce qui se traduit par un nombre de cycles-charge décharge élevé (2000). L’énergie spécifique de ce type d’accumulateur n’est néanmoins que d’environ 90 Wh/kg, plus faible que pour le lithium. Le sodium est aussi un élément plus lourd, ce qui augmente la masse des batteries, mais est bien plus facile à extraire.
L’écoconception des batteries est enfin un champ d’application de la recherche pouvant être améliorée et devenant nécessaire pour le traitement des déchets issus des batteries. La réflexion sur les procédés de création de batteries comme la synthèse des matériaux des électrodes est loin d’être actuellement satisfaisante d’un point de vue de développement durable et de consommation d’énergie.
4.4. Des enjeux écologiques
Le développement important du nombre de batteries, notamment Li-ions, et celles au plomb entrainent un risque sévère sur l’environnement que les pouvoirs publics s’efforcent de contrôler. Il est obligatoire d’inscrire sur les piles et accumulateurs les matériaux utilisés (en particulier les matériaux toxiques), la capacité, et un sigle indiquant qu’il ne faut pas jeter indistinctement ces composants (poubelle barrée). La quantité de certains de ces métaux toxiques, comme le mercure ou le cadmium, est maintenant limitée. Deux organismes (Corepile et Screlec) sont chargés par l’État français de la récupération et du traitement des déchets liés aux générateurs électrochimiques primaires et secondaires.
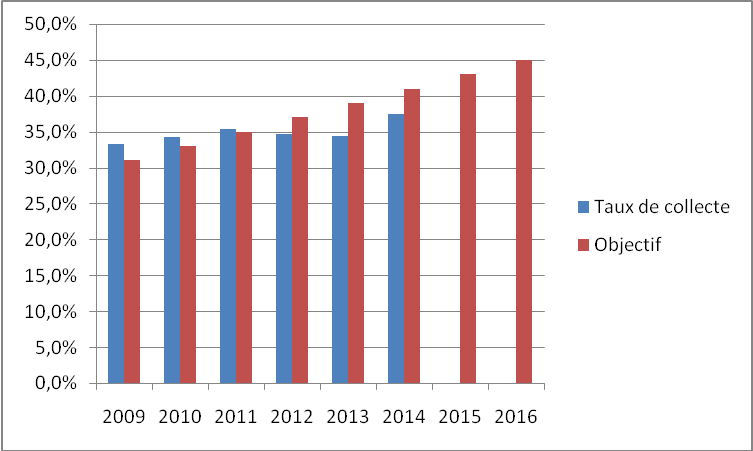
On peut définir leur taux de collecte comme le rapport en masse des batteries collectées, sur celle des batteries mises sur le marché en France. Ce taux peut être amorti sur plusieurs années pour une indication plus précise. C’est une donnée calculée par l’Agence de l’environnement et de la maitrise de l’énergie (ADEME). Le taux de collecte des piles et accumulateurs en France en 2014 était de 37,5 %, en hausse par rapport à 2009. On peut observer son évolution grâce à la Figure 7. Il n’apparait pas une forte augmentation de la collecte malgré les efforts mis en œuvre, car elle est limitée par la baisse des mises sur le marché de générateurs électrochimiques (diminution de 6 % en masse en 2014).
En particulier, la mise sur le marché d’accumulateurs Li-ions progresse de 18 % en masse, grâce aux voitures électriques et aux téléphones, s’élevant à 10 000 tonnes en 2014, mais reste bien moins commercialisée que les batteries au plomb (161 000 tonnes). Le coût de collecte des déchets, piles et accumulateurs, est évalué entre 900 et 1700 euros par tonnes.
À cette donnée de collecte, s’ajoute une donnée tout aussi pertinente : le taux de traitement, qui constitue le rapport en masse du matériel traité sur celle des batteries et piles collectées. Cela représente 227 000 tonnes de piles et accumulateurs traitées en 2014.
Il découle alors un rendement de recyclage correspondant à la valorisation des déchets. Il est de 84 % pour les batteries au plomb et de 71 % pour les batteries au lithium-ions, en France. La valorisation des déchets va devenir un enjeu majeur au vu de la multiplication des accumulateurs et doit être pensée dès aujourd’hui bien que ne pouvant avoir un réel impact que dans dix à quinze ans, c’est-à-dire à la fin de la durée de vie des batteries commercialisée actuellement. La collecte et le recyclage deviennent d’autant plus importants lorsque l’on sait qu’un ménage français possède en moyenne 75 piles et accumulateurs, dont quatre usagés et huit neuves.
La société iséroise Recupyl basée à Domène, spécialisée dans les batteries Li-ions de nouvelle technologie et le recyclage annonce un taux de récupération du lithium contenue dans les batteries Li-ions de l’ordre de 98 %. C’est une compétence rare et prisée dans le monde. Cependant, il faut relativiser les quantités de matériaux pouvant être récupérés, car la masse de lithium capter de cette manière en France en 2014 ne dépasse pas la tonne. Une future valorisation parfaite et totale des accumulateurs Li-ions permettrait à terme d’obtenir par exemple 1000 tonnes de cobalt recyclé et de réduire la dépendance des constructeurs nationaux aux importations de métaux rares et stratégiques.
Les accumulateurs, en particulier Li-ions peuvent aussi constituer un moyen de réduire l’impact sur l’environnement de la production d’énergie, en stockant l’électricité produite lorsqu’elle n’est pas utilisée.
Ils pourraient permettre à terme de supplanter les énergies fossiles utilisées dans les centrales thermiques chargées de produire de l’énergie en cas de défaillance du réseau principal (en particulier lorsque celui-ci dépend d’énergie renouvelable). C’est notamment le cas en Allemagne où les centrales thermiques (charbon, fioul, gaz) sont largement utilisées et émettent beaucoup de CO2 depuis l’arrêt des centrales nucléaires et le développement des moyens de production renouvelables afin de pallier l’inconstante de ces procédés de production. Les accumulateurs pourraient dans ce cas alimenter le réseau lors d’un manque de vent ou de soleil.
Néanmoins, les batteries Li-ions ne rivalisent pas pour le moment face à la méthode actuelle de valorisation de l’énergie surproduite que sont les stations de transfert d’énergie par pompage (STEP). En effet, les STEP représentent 99 % des capacités mondiales de stockage d’énergie en masse. Celles-ci stockent de l’eau en hauteur en la pompant (lui faisant gagner de l’énergie potentielle) grâce à l’énergie surproduite. Cette eau peut ensuite reproduire de l’électricité dans une centrale hydraulique. Ce procédé à un rendement global de l’ordre de 80 %.
Cependant, les accumulateurs sont plus flexibles et permettent de délivrer l’électricité nécessaire plus rapidement qu’une STEP, mais ils ne peuvent pas stocker autant d’énergie (quelques dizaines de mégawattheures pour les batteries contre quelques gigawattheures pour les STEP) pour un coût actuellement assez équivalent. L’installation d’accumulateur pour le stockage demande un investissement d’approximativement 1,2 € par Watt (cas d’une implantation en 2013 en Guyane par EDF). La branche EDF Systèmes électriques insulaires (EDFSEI) a également installé un ensemble de batteries pour une puissance de 1 MW en 2009 à la Réunion. Les accumulateurs Li-ions apparaissent des réserves dynamiques d’énergie bien adaptée pour ces cas. De plus, la technologie va tendre à compléter les STEP pour former un mix de capacité de stockage performant, ou encore pour des particuliers produisant leur propre électricité.
Conclusion
Ainsi le futur des accumulateurs semble prometteur. L’intensification des besoins qu’ils couvrent leur ouvre des perspectives économiques attirantes. De nombreux acteurs industriels et étatiques investissent dans le développement de cette technologie qui accroitra son importance stratégique au cours des prochaines décennies. Cette recherche d’améliorations reste nécessaire afin d’atteindre les performances qui étendront toujours plus les possibilités d’applications des accumulateurs. Le perfectionnement des batteries tend à réduire l’empreinte environnementale de la production et du stockage d’énergie. Les accumulateurs apparaissent comme le futur du stockage d’énergie.
L’actualisation ci dessous est par François Daumard (2022). La filière de stockage stationnaire est en pleine explosion en France et en Europe. Le Monde de l’Energie, 27.10.2022
Aux dires du président de Valeco, le stockage par batterie est très en retard en France (400 MW de projets installés) par rapport à
l’Allemagne (500) et surtout au Royaume-Uni (1 700). En cause : une ouverture du marché récente (2017), l’absence d’appels d’offre dédiés
au stockage, la profondeur limitée du marché (500 MW) de la réserve primaire.
Cette situation change cependant avec l’appel d’offres long terme de RTE en 2019 et plus encore le décret du 6 mai 2022 qui laisse à cette
entreprise la possibilité de recourir à un appel d’offre spécifique stockage, en réponse à un mix énergétique vers des moyens de production
décentralisés. A quoi s’ajoute la division par cinq, en 10 ans, des coûts de production des batteries Li-ion que pourrait rejoindre le stockage
par hydrogène ou celui par volant d’inertie.
A plus long terme, outre les Stations de Transfert d’Energie par Pompage (STEP), le power to gas et le gas to power aura probablement
toute sa place, notamment grâce au stockage d’hydrogène vert ultérieurement reconverti en électricité, en vue :
– d’une décarbonation de mobilité lourde (camion, bus, bateau) ;
– d’une décarbonation des procédés industriels (aciéries, verreries ou pétrochimie) ;
– d’une injection dans les réseaux de gaz ;
– d’une restitution sur le réseau électrique à des moments plus opportuns.
L’Europe et les Etats membres croient à ces perspectives avec des plans gigantesques de financement pour lancer la filière et améliorer le
rendement et le volume de projet qui aura un effet immédiat sur le prix de l’hydrogène renouvelable.
Bibliographie complémentaire :
Linden David, Reddy B. Thomas. Handbook Of Batteries. McGraw-Hill Handbooks.
Lucas Thierry (7 avril 2011). L’usine nouvelle.
Verchier Yann, Lemaître Frederic. De l’oxydoréduction à l’électrochimie. Ellipses.
Miomandre Fabien, Sadhi Saïd, Audebert Pierre, Meallet-Renault Rachel. Électrochimie : Des concepts aux applications. Dunod.
http://www.ccfa.fr/Le-marche-des-batteries-lithium,119 269
http://www.developpement-durable.gouv.fr/IMG/pdf/Nucleaire.pdf
https://lejournal.cnrs.fr/articles/batterie-sodium-ion-une-revolution-en-marche
http://www.consoglobe.com/batteries-revolutionnaires-cg
http://pulse.edf.com/fr/les-batteries-du-futur-sont-en-preparation
L’Encyclopédie de l’Énergie est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article, merci de mentionner le nom de l’auteur, le titre de l’article et son URL sur le site de l’Encyclopédie de l’Énergie.
Les articles de l’Encyclopédie de l’Énergie sont mis à disposition selon les termes de la licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Pas de Modification 4.0 International.